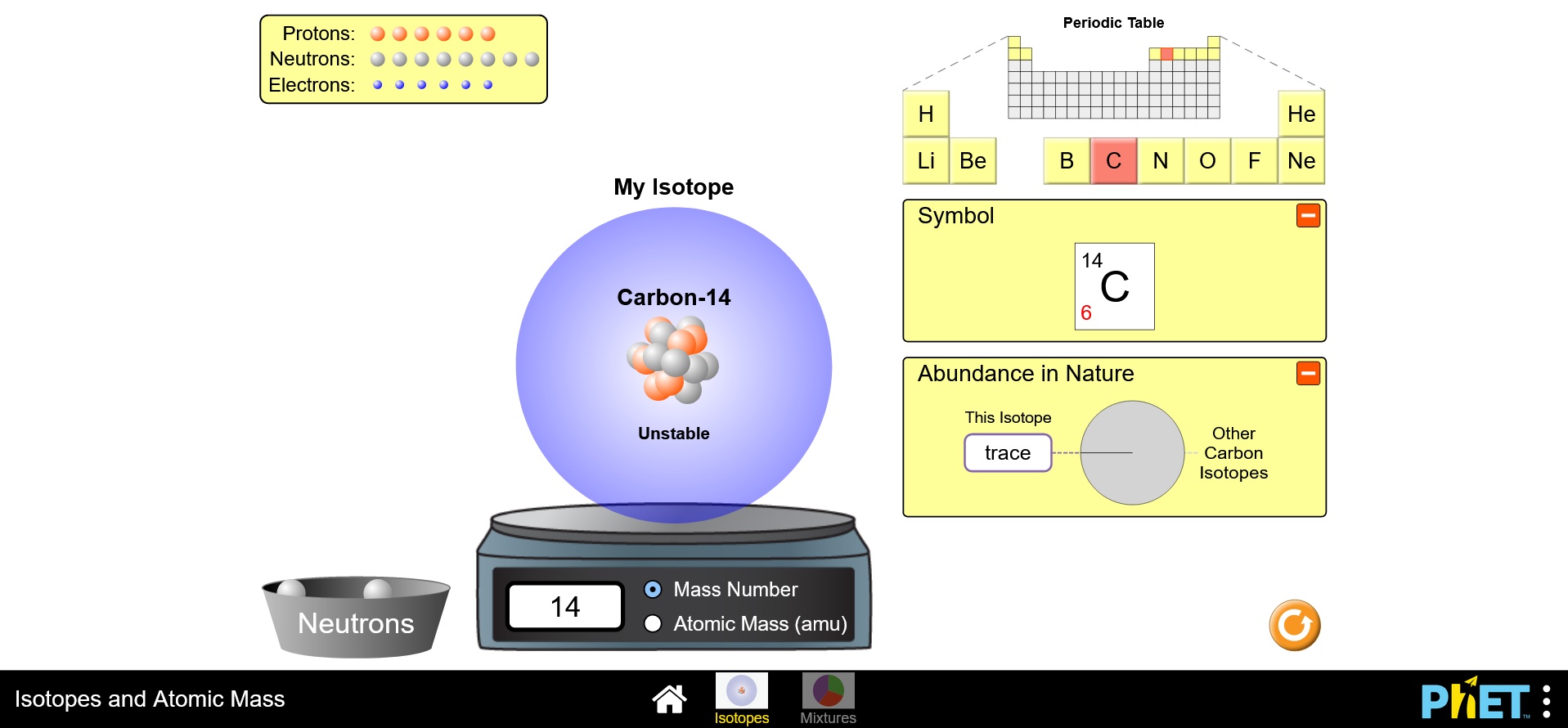
ไอโซโทป
ไอโซโทป เป็นความแตกต่างขององค์ประกอบทางเคมีของธาตุ โดยธาตุที่เป็นไอโซโทปกันจะมีโปรตอนและอิเล็กตรอนเท่ากัน แต่มีจำนวนนิวตรอนในนิวเคลียสที่แตกต่างกัน ดังนั้น มวลอะตอมของธาตุที่เป็นไอโซโทปกันจึงแตกต่างกันด้วย โดยอาจเพิ่มขึ้นหรือลดลงได้ตามจำนวนนิวตรอนที่ต่างกัน ตัวอย่างเช่น คาร์บอน-14, คาร์บอน-13 และ คาร์บอน-12 เป็นไอโซโทปของคาร์บอนทั้งหมด ทั้งนี้คาร์บอน-14 มีทั้งหมด 8 นิวตรอน, คาร์บอน-13 มีทั้งหมด 7 นิวตรอน และ คาร์บอน-12 มีทั้งหมด 6 นิวตรอน แต่ทั้งหมดนี้จะมีโปรตอนจำนวน 6 โปรตอนเท่ากัน
การเขียนไอโซโทป เขียนได้ 2 แบบ คือ 1) การเขียนชื่อธาตุตามด้วยยัติภังค์และมวลอะตอมของไอโซโทป เช่น ยูเรเนียม-235 และยูเรเนียม-239 2) เขียนสัญลักษณ์ของธาตุและนำหน้าด้วยเลขมวลและเลขอะตอม เช่น ไอโซโทปยูเรเนียม-235 เขียนได้เป็น ![]() และไอโซโทปยูเรเนียม-239 เขียนได้เป็น
และไอโซโทปยูเรเนียม-239 เขียนได้เป็น ![]()
มวลอะตอม
มวลอะตอม คือ มวลเฉลี่ยของอะตอมของธาตุ มีหน่วยเป็น amu สำหรับอะตอมทั่วไป มวลของโปรตอนและนิวตรอนรวมกันเกือบจะเป็นมวลทั้งหมดของอะตอม
คลิกที่ภาพเพื่อทำการทดลองเรื่องไอโซโทปและมวลอะตอม