พันธะเคมี (ตะลุยโจทย์)


พันธะเคมี คือ แรงยึดเหนี่ยวระหว่างอะตอมกับอะตอม หรือไอออนกับไอออนในโมเลกุลหรือสารประกอบ โดยเกิดจากแรงดึงดูดระหว่าง e- กับ p ในนิวเคลียส
พลังงานพันธะ คือ พลังงานที่น้อยที่สุดที่ใช้เพื่อสลายพันธะระหว่างอะตอมในโมเลกุลที่อยู่ในสถานะก๊าซออกเป็นอะตอมเดี่ยว
กฎออกเตต กล่าวถึง การจัดเรียงอะตอมของธาตุต่าง ๆ ที่จะมีความเสถียรได้ก็ต่อเมื่อมีเวเลนซ์อิเล็กตรอนวงนอกสุดเท่ากับ 8 ซึ่งจะเกิดขึ้นได้จากอิเล็กตรอนของตัวมันเองหรือการใช้อิเล็กตรอนบางตัวร่วมกันกับอะตอมอื่น โดยแต่ละอะตอมจึงมีการสร้างพันธะต่อกันขึ้นมากระทั่งเวเลนซ์อิเล็กตรอนวงนอกสุดครบ 8
1. พันธะภายในโมเลกุล
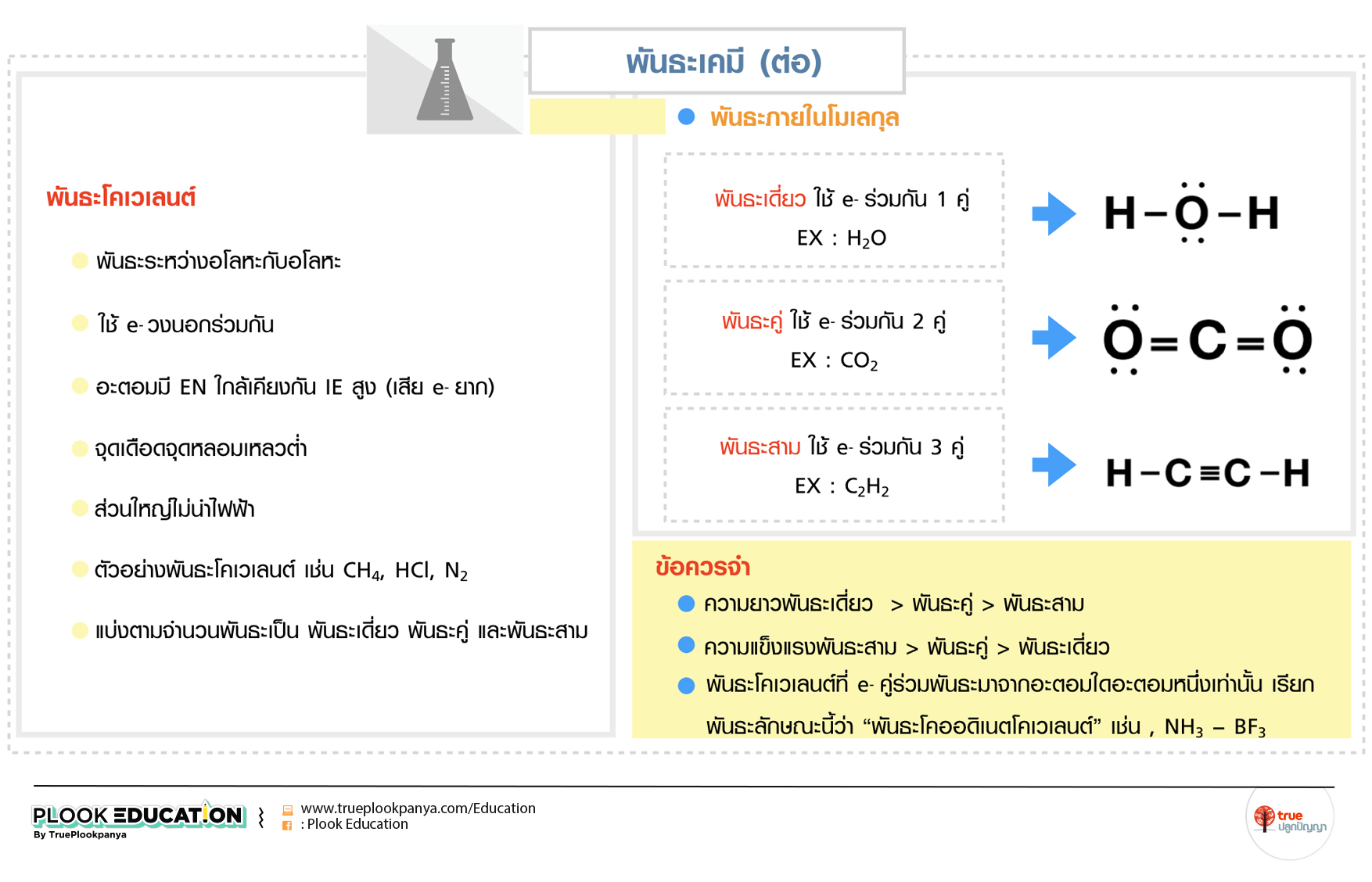
พันธะโคเวเลนต์
- พันธะระหว่างอโลหะกับอโลหะ
- ใช้ e- วงนอกร่วมกัน
- อะตอมมี EN ใกล้เคียงกัน IE สูง (เสีย e- ยาก)
- จุดเดือดจุดหลอมเหลวต่ำ
- ส่วนใหญ่ไม่นำไฟฟ้า
- ตัวอย่างพันธะโคเวเลนต์ เช่น CH4, HCl, N2
- แบ่งตามจำนวนพันธะเป็น พันธะเดี่ยว พันธะคู่ และพันธะสาม
ข้อควรจำ
- ความยาวพันธะเดี่ยว > พันธะคู่ > พันธะสาม
- ความแข็งแรงพันธะสาม > พันธะคู่ > พันธะเดี่ยว
- พันธะโคเวเลนต์ที่ e- คู่ร่วมพันธะมาจากอะตอมใดอะตอมหนึ่งเท่านั้น เรียกพันธะลักษณะนี้ว่า “พันธะโคออดิเนตโคเวเลนต์”
พันธะไอออนิก
- พันธะระหว่างโลหะกับอโลหะ ยกเว้น Be, B, Sn เป็นโคเวเลนต์
- โลหะให้ e- อโลหะรับ e-
- อะตอมของโลหะ EN ต่ำ อะตอมของอโลหะ EN สูง
(EN ต่างกันมาก ความเป็นไอออนิกมาก
EN ต่างกันน้อย ความเป็นไอออนิกน้อย หรือเป็นโคเวเลนต์
EN เท่ากัน เป็นโคเวเลนต์ 100%)
- จุดเดือดจุดหลอมเหลวสูง
- ละลายน้ำแล้วแตกตัวเป็นไอออน นำไฟฟ้าได้
- ตัวอย่างพันธะไอออนิก เช่น NaCl, Li2O, MgCl2, Al2O3
พลังงานในการเกิดสารประกอบไอออนิก
วัฏจักรบอร์นฮาเบอร์
1. พลังงานการระเหิด Na (s) => Na (g) ΔHsub = 107 kJ
2. พลังงานไอออไนเซชัน Na (g) => Na+ (g) + e- IE = 496 kJ
3. พลังงานสลายพันธะ ½Cl2 => Cl (g) ½D = 122 kJ
4. สัมพรรคภาพอิเล็กตรอน Cl (g) + e- => Cl- (g) EA = -349 kJ
5. พลังงานแลตทิซ Na+ (g) + Cl- => NaCl (s) U = -787 kJ
สมการรวมของปฏิกิริยาเป็นดังนี้ Na (s) + ½Cl2 (g) => NaCl (s)
พลังงานรวมของการเกิดปฏิกิริยา ΔHf = -411 kJ
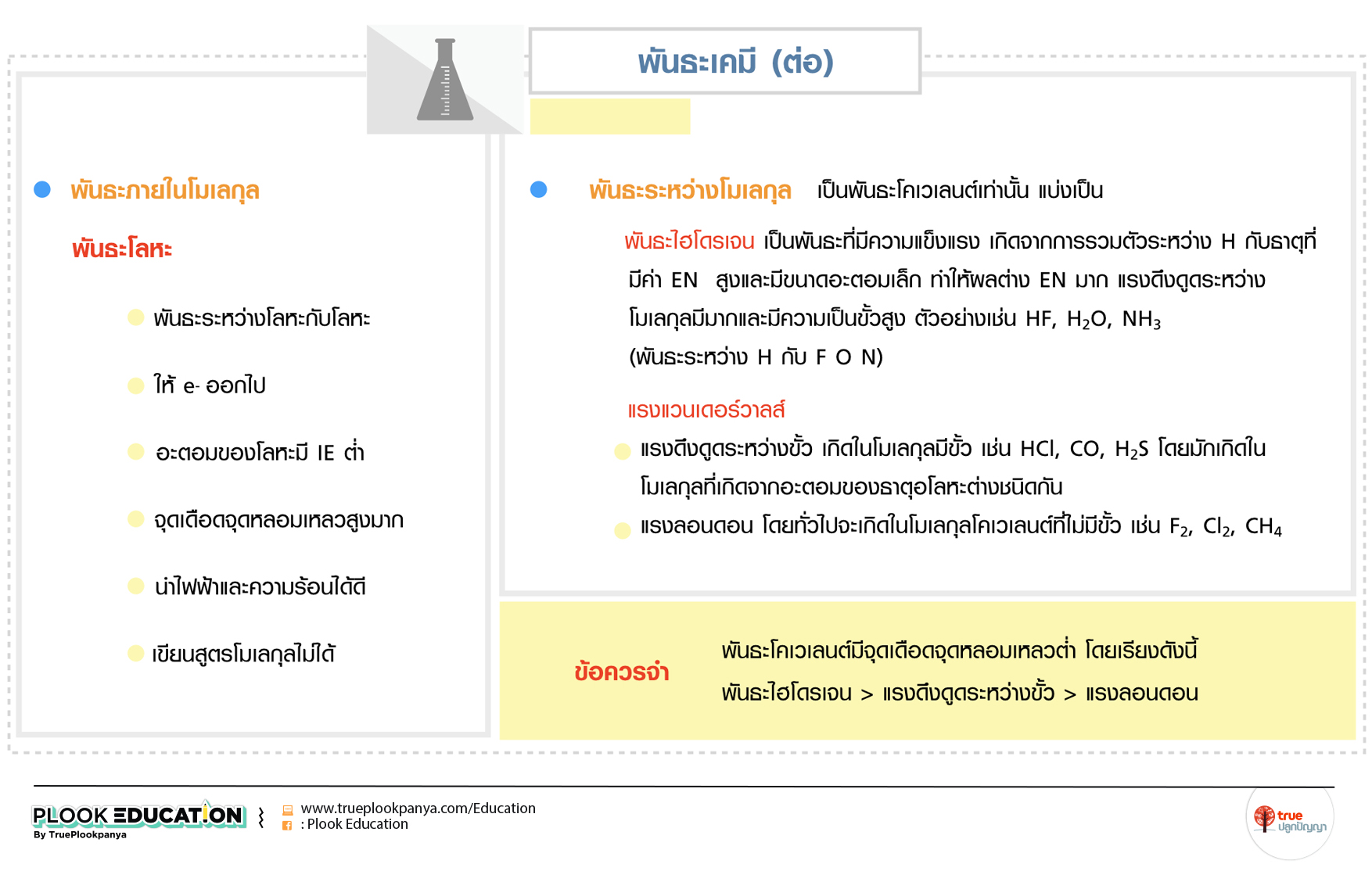
พันธะโลหะ
- พันธะระหว่างโลหะกับโลหะ
- ให้ e- ออกไป
- อะตอมของโลหะมี IE ต่ำ
- จุดเดือดจุดหลอมเหลวสูงมาก
- นำไฟฟ้าและความร้อนได้ดี
- เขียนสูตรโมเลกุลไม่ได้
2. พันธะระหว่างโมเลกุล เป็นพันธะโคเวเลนต์เท่านั้น แบ่งเป็น
พันธะไฮโดรเจน เป็นพันธะที่มีความแข็งแรง เกิดจากการรวมตัวระหว่าง H กับธาตุที่มีค่า EN สูงและมีขนาดอะตอมเล็ก ทำให้ผลต่าง EN มาก แรงดึงดูดระหว่างโมเลกุลมีมากและมีความเป็นขั้วสูง ตัวอย่างเช่น HF, H2O, NH3 (พันธะระหว่าง H กับ F O N)
แรงแวนเดอร์วาลส์
- แรงดึงดูดระหว่างขั้ว เกิดในโมเลกุลมีขั้ว เช่น HCl, CO, H2S โดยมักเกิดในโมเลกุลที่เกิดจากอะตอมของธาตุอโลหะต่างชนิดกัน
- แรงลอนดอน โดยทั่วไปจะเกิดในโมเลกุลโคเวเลนต์ที่ไม่มีขั้ว เช่น F2, Cl2, CH4
ข้อควรจำ
- พันธะโคเวเลนต์มีจุดเดือดจุดหลอมเหลวต่ำ โดยเรียงดังนี้ พันธะไฮโดรเจน > แรงดึงดูดระหว่างขั้ว > แรงลอนดอน

