ตอนที่ 1 โครงสร้างอะตอม
ผังมโนทัศน์สาระการเรียนรู้
สาระสำคัญประจำหน่วย
1. แบบจำลองอะตอมแสดงให้เห็นถึงลักษณะการจัดเรียงตัวของอนุภาคมูลฐานภายในอะตอมซึ่งประกอบด้วย โปรตอน นิวตรอน และอิเล็กตรอน
2. โปรตอนและนิวตรอนรวมอยู่ในนิวเคลียส และมีอิเล็กตรอนเคลื่อนที่อยู่รอบนอกในระดับพลังงานต่าง ๆ
3. จำนวนอนุภาคมูลฐานของอะตอมแสดงสัญลักษณ์นิวเคลียร์ เลขอะตอมคือจำนวนโปรตอน ส่วนเลขมวล คือผลรวมของจำนวนโปรตอนและนิวตรอน
4. ธาตุจะมีจำนวนโปรตอนและอิเล็กตรอนเท่ากันเสมอ ส่วนจำนวนนิวตรอนอาจเท่ากันหรือแตกต่างกับจำนวนโปรตอนหรืออิเล็กตรอนก็ได้
5. จำนวนโปรตอนของธาตุชนิดเดียวกันจะต้องมีค่าเท่ากัน แต่ธาตุต่างชนิดกันจะมีค่าของจำนวนโปรตอนไม่เท่ากัน
6. ธาตุไอโซโทปคือธาตุที่มีจำนวนโปรตอนเท่ากันแต่จำนวนนิวตรอนต่างกัน
7. อิเล็กตรอนในแต่ละระดับพลังงานจะมีจำนวนได้มากที่สุดเท่ากับ 2n2 (n = ระดับพลังงาน)
8. เวเลนซ์อิเล็กตรอนคืออิเล็กตรอนที่อยู่ในระดับพลังงานชั้นนอกสุด
9. สมบัติบางประการและการเกิดปฏิกิริยาเคมีของธาตุขึ้นอยู่กับเวเลนซ์อิเล็กตรอน
10. ธาตุโลหะมีแนวโน้มในการสูญเสียเวเลนซ์อิเล็กตรอนได้ง่ายเมื่อเกิดปฏิกิริยา แล้วกลายเป็นไอออนที่มีประจุไฟฟ้าเป็นบวก
11. ธาตุอโลหะมีแนวโน้มในการดึงดูดเวเลนซ์อิเล็กตรอนเข้ามาในอะตอมเมื่อเกิดปฏิกิริยา แล้วกลายเป็นไอออนที่มีประจุเป็นลบ
12. ธาตุที่มีเวเลนซ์อิเล็กตรอนเท่ากับ 8 จะไม่ไวต่อการเกิดปฏิกิริยาและมีเสถียรภาพสูง
Keywords
แบบจำลองอะตอม : สิ่งที่แสดงให้เห็นถึงลักษณะการจัดเรียงตัวของอนุภาคมูลฐานภายในอะตอม
อนุภาคมูลฐานของอะตอม : อิเล็กตรอน โปรตรอน และนิวตรอน
สัญลักษณ์นิวเคลียร์ : สัญลักษณ์ของธาตุแทนรายละเอียดเกี่ยวกับจำนวนอนุภาคมูลฐานของอะตอม
เลขมวล : ตัวเลขแทนผลบวกของจำนวนโปรตอนและนิวตรอน
เลขอะตอม : แทนจำนวนโปรตอนในนิวเคลียส
เวเลนซ์อิเล็กตรอน : อิเล็กตรอนที่อยู่ในระดับพลังงานชั้นนอกสุด
ไอโซโทป : ธาตุที่มีจำนวนโปรตอนเท่ากันแต่จำนวนนิวตรอนต่างกัน
แบบจำลองอะตอม
อะตอม (Atom) หมายถึง มองไม่เห็น ซึ่งนักวิทยาศาสตร์ได้ให้ความสนใจและศึกษาอะตอมโดยใช้แบบจำลองอะตอม (atom model) ซึ่งเป็นสิ่งที่สร้างขึ้นตามแนวคิดเพื่อแสดงลักษณะและการทำงาน ของอะตอม โดยใช้การสังเกตและข้อมูลจากการทดลอง
แบบจำลองอะตอมของดอลตัน
จอห์น ดอลตัน (John Dalton) อธิบายถึงลักษณะและสมบัติของอะตอมไว้ว่า ธาตุประกอบด้วยอนุภาคเล็ก ๆ หลายอนุภาคที่เรียกว่าอะตอม ซึ่งแบ่งแยกและทำให้สูญหายไม่ได้ อะตอมของธาตุชนิดเดียวกันจะมีสมบัติเหมือนกัน แต่จะมีสมบัติแตกต่างจากอะตอมของธาตุอื่น และสารประกอบเกิดจากอะตอมของธาตุมากกว่าหนึ่งชนิดทำปฏิกิริยาเคมีกันในอัตราส่วนที่เป็นเลขลงตัวน้อย ๆ อย่างไรก็ตามได้พบข้อมูลบางประการที่ไม่สอดคล้องกับแนวคิดของดอลตัน เช่น พบว่าอะตอมประกอบด้วยอนุภาคย่อย ๆ และอะตอมของธาตุชนิดเดียวกันมีมวลแตกต่างกันได้

แบบจำลองอะตอมของทอมสัน
เซอร์โจเซฟ จอห์น ทอมสัน (Sir Josept John Thomson) ได้เสนอแบบจำลองอะตอมว่า อะตอมมีลักษณะเป็นทรงกลม ประกอบด้วยอนุภาคโปรตอนซึ่งมีประจุบวก และอิเล็กตรอนซึ่งมีประจุลบกระจายอยู่ทั่วไปอย่างสม่ำเสมอ อะตอมที่เป็นกลางทางไฟฟ้าจะมีจำนวนประจุบวกเท่ากับประจุลบ
การทดลองของเขาได้ทำการศึกษาอนุภาคในหลอดรังสีแคโทดเมื่อผ่านไฟฟ้ากระแสตรงเข้าไป ซึ่งทำให้ค้นพบอนุภาคที่มีประจุลบ เรียกว่า อิเล็กตรอน (electron) ต่อมาออยเกน โกลด์ชไตน์ (Eugen Goldstein) ได้ทำการทดลองเพิ่มเติมโดยดัดแปลงหลอดรังสีแคโทดใหม่ ทำให้พบว่ามีประจุบวกเกิดขึ้น เรียกว่า โปรตอน (proton)

แบบจำลองอะตอมของรัทเทอร์ฟอร์ด
ลอร์ดเออร์เนสต์ รัทเทอร์ฟอร์ด (Lord Ernest Rutherford) ทำการทดลองยิงอนุภาคแอลฟาซึ่งมีประจุบวกไปยังแผ่นทองคำบาง ๆ แล้วมีการเรืองแสงขึ้นที่ฉากรับพบว่ามีการเรืองแสงเกิดที่บริเวณด้านหน้าแผ่นทองคำ ซึ่งเป็นผลที่ไม่สอดคล้องกับแบบจำลองอะตอมของทอมสันที่เสนอว่าโปรตอนกระจายอยู่ทั่วอะตอม รัทเทอร์ฟอร์ดจึงเสนอแบบจำลองอะตอมใหม่ว่า อะตอมประกอบด้วยนิวเคลียสที่มีขนาดเล็กมากอยู่ตรงกลางและมีประจุไฟฟ้าเป็นบวก โดยมีอิเล็กตรอนเคลื่อนที่อยู่รอบ ๆ ซึ่งแบบจำลองดังกล่าวยังไม่สามารถอธิบายถึงการจัดเรียงหรือการเคลื่อนที่อิเล็กตรอนรอบนอกนิวเคลียสได้

แบบจำลองอะตอมของโบร์
นิลส์ โบร์ (Niels Bohr) ได้สร้างแบบจำลองอะตอมโดยใช้ความรู้เรื่องการเปลี่ยนแปลงระดับพลังงานของอิเล็กตรอนและการเกิดสเปกตรัม นั่นคือ อิเล็กตรอนจะเคลื่อนที่เป็นวงรอบนิวเคลียสในระดับพลังงานของอิเล็กตรอนต่าง ๆ กัน คล้ายดาวเคราะห์ที่โคจรรอบดวงอาทิตย์ ซึ่งแต่ละวงจะมีระดับพลังงานเฉพาะตัว ทั้งนี้แบบจำลองดังกล่าวยังไม่สามารถอธิบายอะตอมที่มีหลายอิเล็กตรอนได้

แบบจำลองอะตอมแบบกลุ่มหมอก
ได้ถูกอธิบายว่า อะตอมประกอบด้วยกลุ่มหมอกอิเล็กตรอนรอบนิวเคลียสบริเวณที่กลุ่มหมอกทึบแสดงว่ามีโอกาสที่จะพบอิเล็กตรอนได้มากกว่าบริเวณที่มีกลุ่มหมอกจาง แบบจำลองนี้สามารถนำไปอธิบายสมบัติต่าง ๆ ของอะตอมได้ในหลายด้าน

อนุภาคมูลฐานของอะตอม
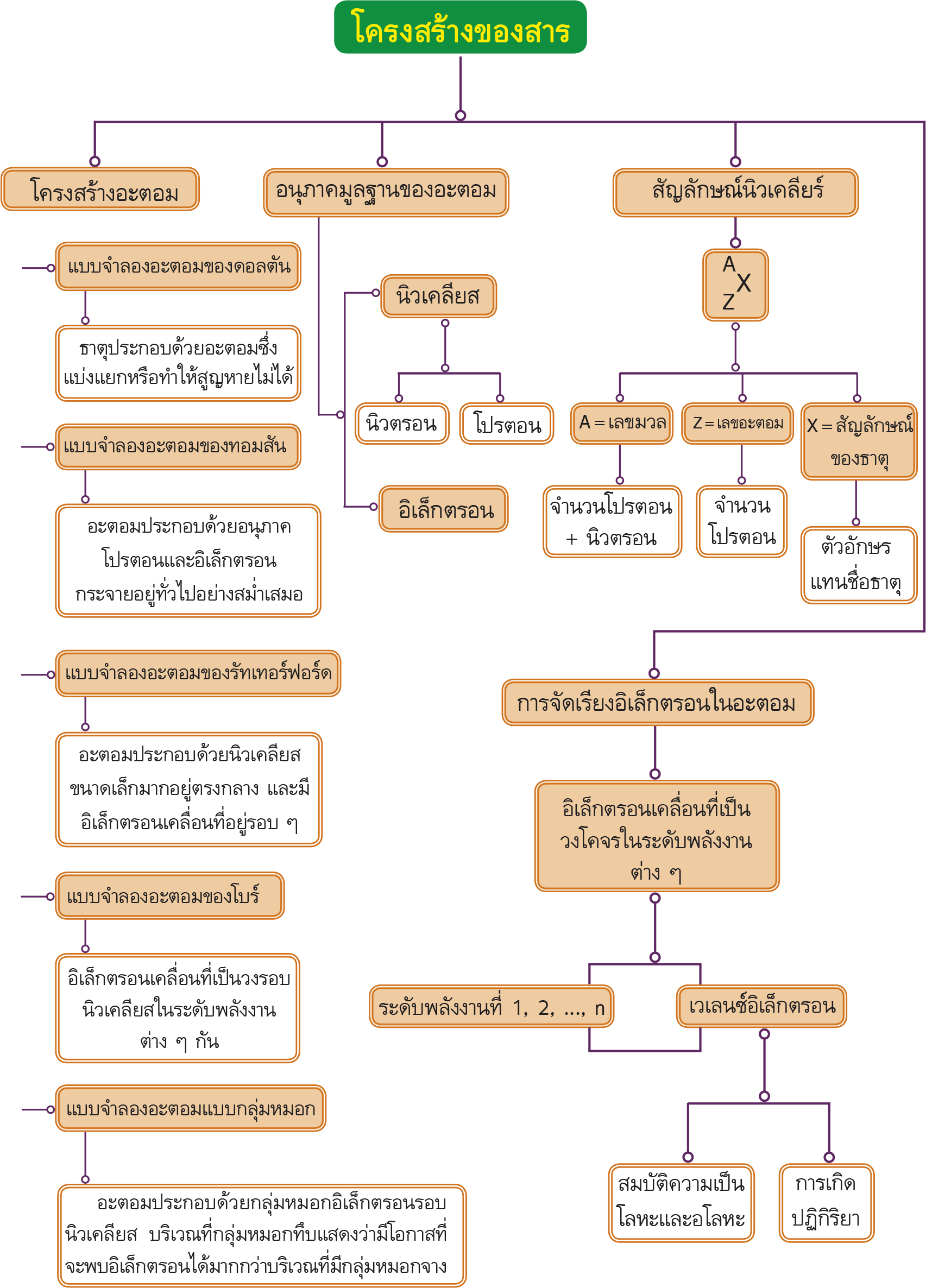
จากการศึกษาพบว่าอะตอมของธาตุจะมีมวลเป็น 2 เท่าของมวลโปรตอน เช่น ธาตุคาร์บอนมีมวลโปรตอน 6 หน่วย และมีมวลอะตอม 12 หน่วย ทำให้สันนิษฐานได้ว่าภายในอะตอมน่าจะมีอนุภาคอีกชนิดหนึ่งอยู่ในนิวเคลียส ซึ่งควรมีมวลใกล้เคียงกับมวลโปรตอนและเป็นกลางทางไฟฟ้า ต่อมาได้ข้อสรุปว่าอนุภาคนี้คือ นิวตรอน (neutron) ทำให้ทราบว่าอะตอมจะประกอบด้วย อนุภาคมูลฐานของอะตอม 3 ชนิด คือ โปรตอน นิวตรอน และอิเล็กตรอน ซึ่งมีสมบัติและความสัมพันธ์
ธาตุจะมีจำนวนโปรตอนและอิเล็กตรอนเท่ากันเสมอ ส่วนจำนวนนิวตรอนอาจเท่ากันหรือแตกต่างกับจำนวนโปรตอนและอิเล็กตรอนก็ได้
ตารางที่แสดงสมบัติของอนุภาคมูลฐานของอะตอม
|
อนุภาค |
สัญลักษณ์ |
มวล (kg) |
ประจุ (c) |
ชนิดของประจุ |
|
โปรตอน นิวตรอน อิเล็กตรอน |
p n e |
1.67 × 10-27 1.67 × 10-27 9.109 × 10-31 |
1.60 × 10-19 0 1.60 × 10-19 |
+1 0 -1 |
สัญลักษณ์นิวเคลียร์
สัญลักษณ์นิวเคลียร์ คือ สัญลักษณ์ของธาตุแทนรายละเอียดเกี่ยวกับจำนวนอนุภาคมูลฐานของอะตอม โดยใช้ตัวอักษรภาษาอังกฤษพิมพ์ใหญ่เป็นสัญลักษณ์แทนชื่อธาตุ ใช้ตัวเลขที่มุมบนซ้ายของตัวอักษรแทนผลบวกของจำนวนโปรตอนและนิวตรอน เรียกว่า เลขมวล (mass number) และตัวเลขที่มุมล่างซ้ายแทนจำนวนโปรตอนในนิวเคลียส เรียกว่า เลขอะตอม (atomic number)
เมื่อ X = สัญลักษณ์ของธาตุ
A = เลขมวล
Z = เลขอะตอม
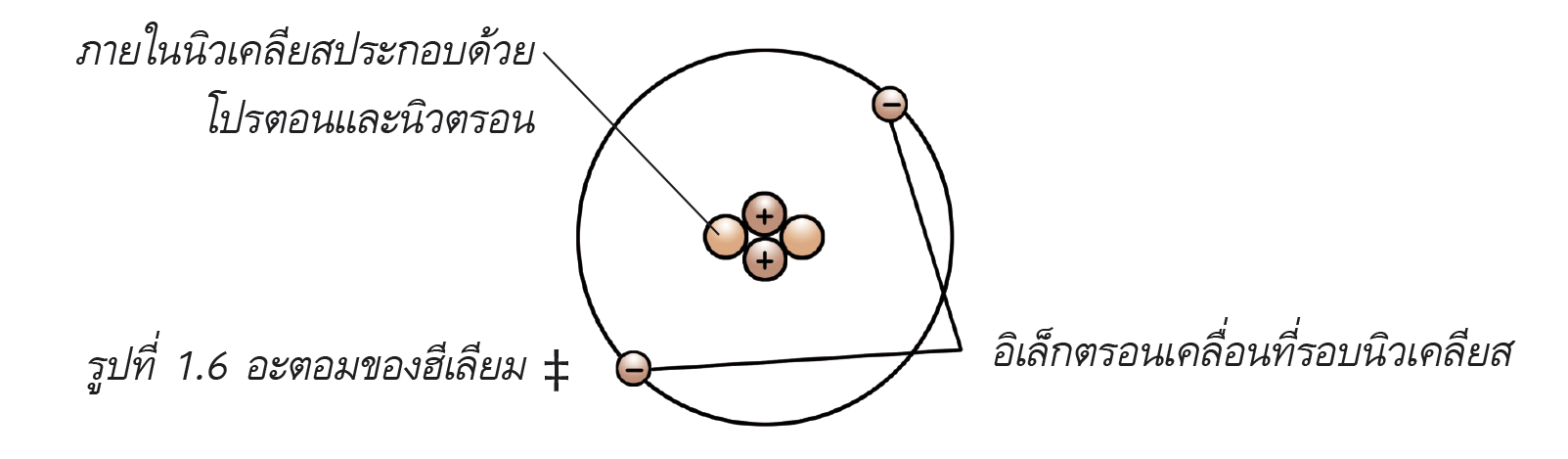
สามารถเขียนสัญลักษณ์นิวเคลียร์ของธาตุบางชนิดได้ เช่น H, He และ C เป็นต้น เลขอะตอมของธาตุแต่ละชนิดจะบ่งชี้ถึงสมบัติเฉพาะตัวของธาตุนั้น ๆ โดยธาตุที่เป็นธาตุไอโซโทป (isotope) กันมีจะมีเลขอะตอมเหมือนกันแต่มีเลขมวลต่างกัน กล่าวคือมีจำนวนโปรตอนเท่ากันแต่จำนวนนิวตรอนต่างกัน เช่น ไฮโดรเจนมี 3 ไอโซโทปคือ 11H, 12H, และ 13H คลอรีนมี 2 ไอโซโทป คือ 1735Cl และ 1737Cl
การจัดเรียงอิเล็กตรอนในอะตอม
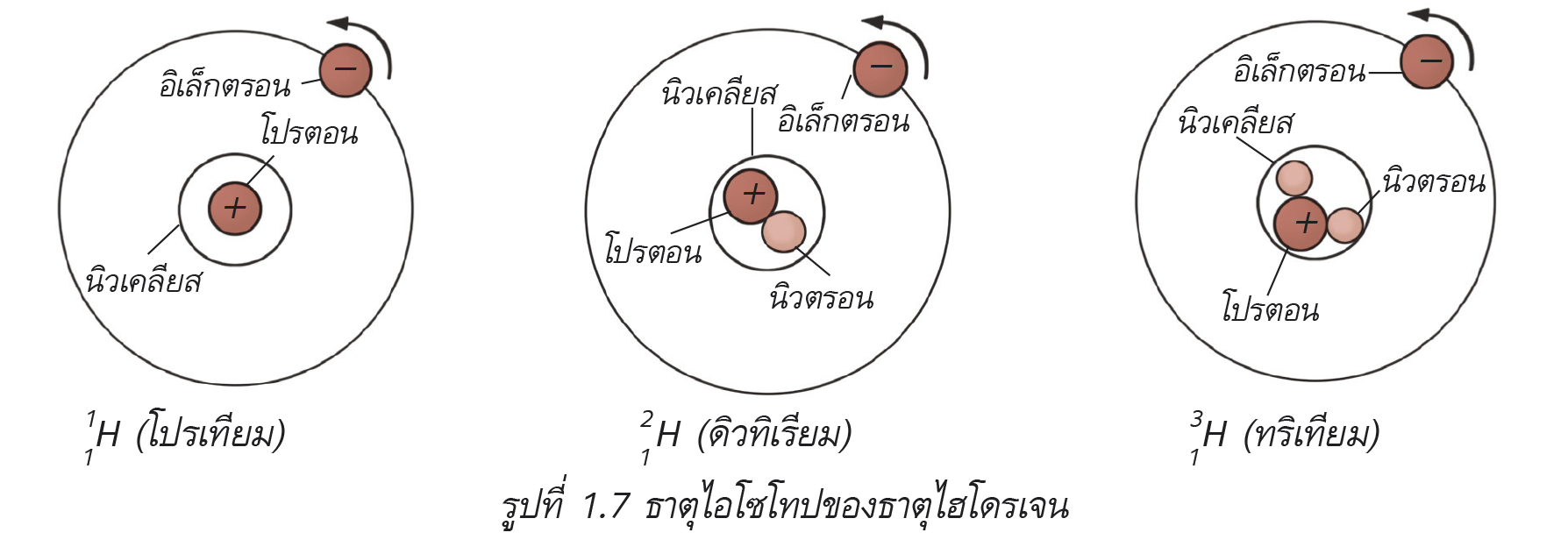
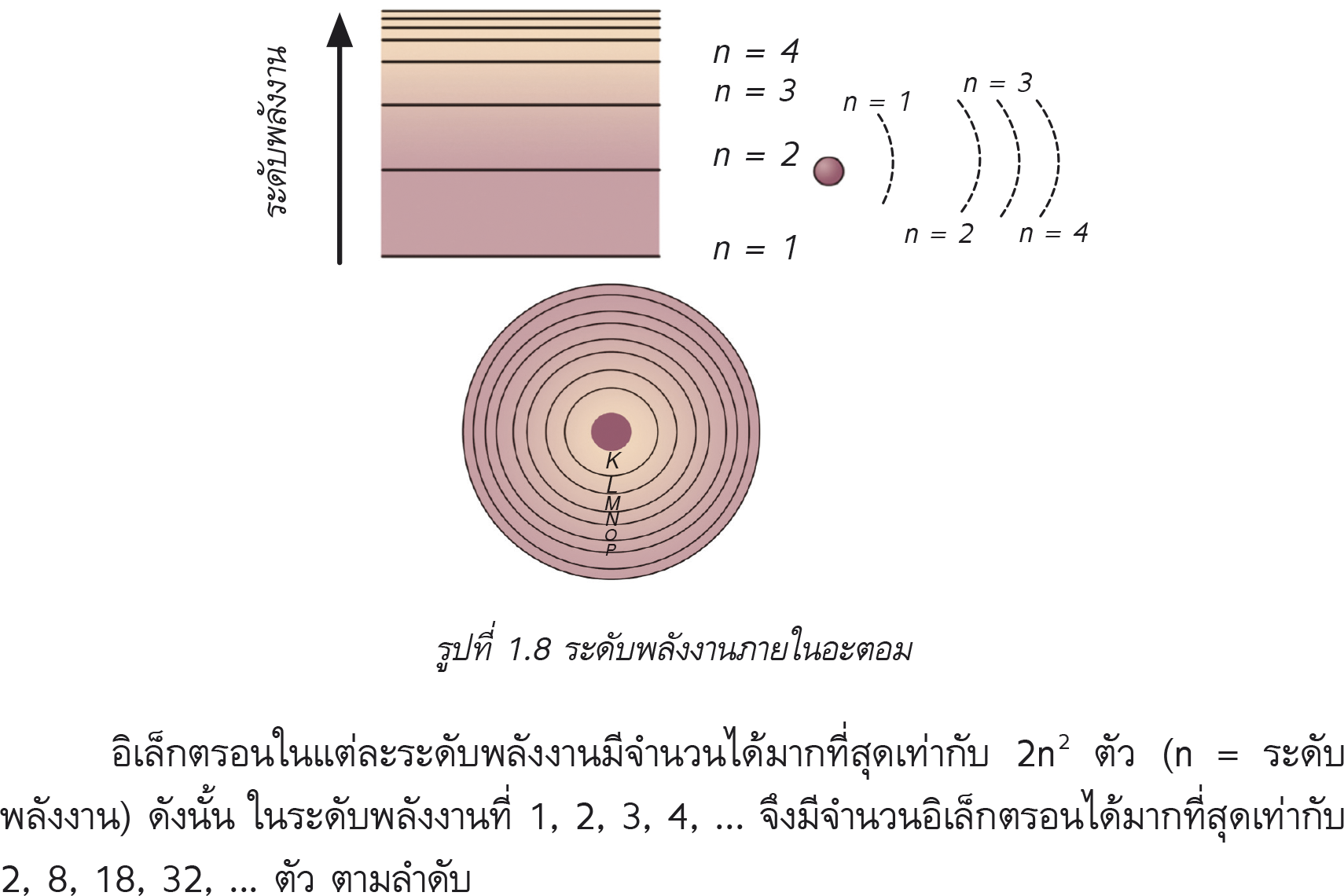
อิเล็กตรอนและนิวเคลียสในอะตอมดำรงอยู่ได้ด้วยแรงดึงดูดระหว่างอิเล็กตรอนที่มีประจุลบกับ นิวเคลียสที่มีประจุบวก ซึ่งอิเล็กตรอนในวงโคจรที่อยู่ใกล้นิวเคลียสที่สุดจะมีพลังงานน้อยที่สุด เรียกว่า ระดับพลังงานที่ 1 หรือชั้น K ส่วนอิเล็กตรอนที่อยู่ไกลออกไปจะมีค่าพลังงานมากขึ้น เรียกว่า ระดับพลังงานที่ 2, 3, 4, … หรือ L, M, N, … ตามลำดับ ในแต่ละระดับพลังงานจะมีอิเล็กตรอนได้มากที่สุดเท่ากับ 2n2 ตัว (n = ระดับพลังงาน) ดังนั้น ในระดับพลังงานที่ 1,2,3,4, … จึงมีจำนวนอิเล็กตรอนได้มากที่สุดเท่ากับ 2, 8, 18, 32, … ตัว ตามลำดับ

ตัวอย่างการจัดเรียงอิเล็กตรอน เช่น Li คือ 2, Na คือ 2, 8, 1 Ar คือ 2, 8, 8 และ K คือ 2, 8, 8, 1 จะเห็นได้ว่าจำนวนอิเล็กตรอนที่อยู่ในระดับพลังงานชั้นนอกสุดหรือที่เรียกว่า เวเลนซ์อิเล็กตรอน (valence electron)ของ Li, Na, Ar และ K เป็น 1, 8, 8 และ 1 ตามลำดับ
หลักการจัดเรียงอิเล็กตรอนในแต่ละระดับพลังงานมีดังนี้
1. จำนวนเวเลนซ์อิเล็กตรอนของอะตอมจะมีได้ไม่เกิน 8 ตัว ซึ่งเป็นภาวะที่อะตอมเกิดความเสถียรมากที่สุดตามกฎออกเตต (octet rule)
2. จำนวนอิเล็กตรอนที่ถัดเข้ามาจากวงนอกสุดจะมีได้ไม่เกิน 18 ตัว
จำนวนเวเลนซ์อิเล็กตรอนเป็นสิ่งที่มีผลต่อสมบัติบางประการของธาตุ เช่น ความเป็นโลหะและอโลหะ รวมไปถึงการเกิดปฏิกิริยา โดยธาตุจะมีการให้และรับอิเล็กตรอนเพื่อให้เวเลนซ์อิเล็กตรอนเสถียรมากที่สุดคือเท่ากับ 8 ตัว
กลุ่มธาตุโลหะ
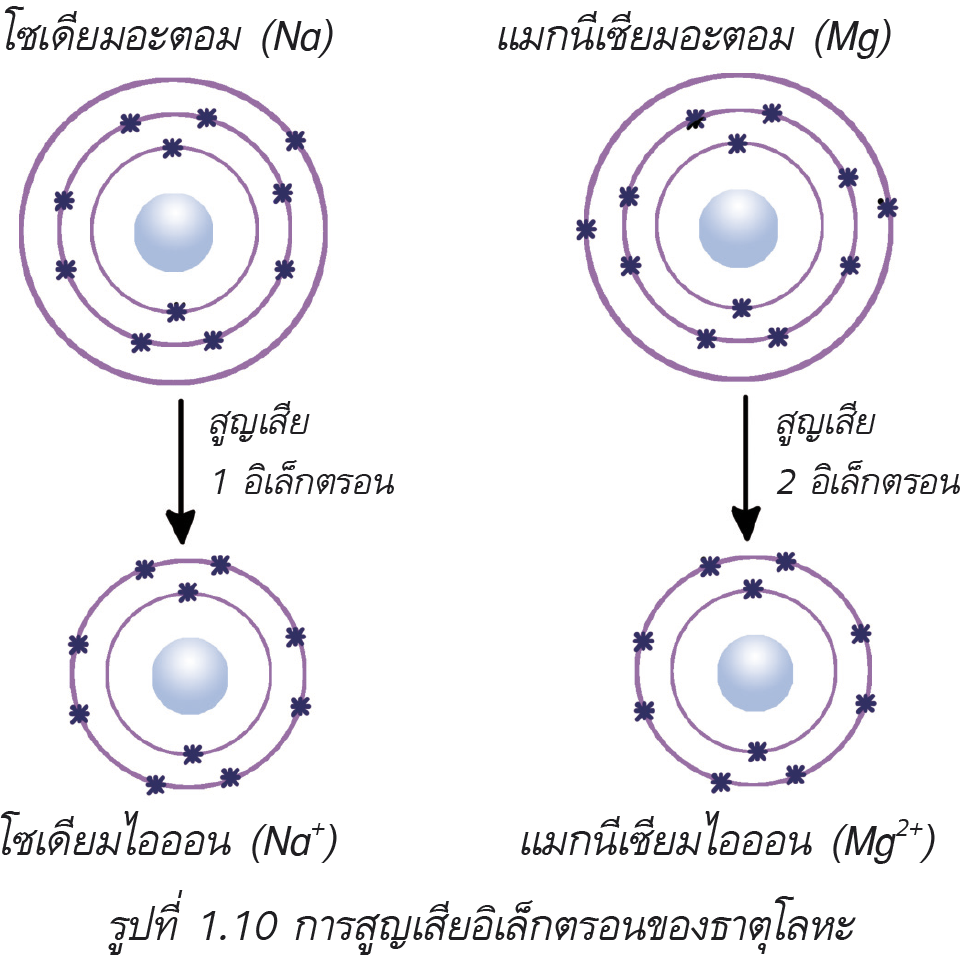
ธาตุที่มีสมบัติเป็นโลหะ (metal) เป็นธาตุที่มีแนวโน้มในการสูญเสียเวเลนซ์อิเล็กตรอนไปได้ง่าย เมื่อเกิดปฏิกิริยาธาตุจะจ่ายเวเลนซ์อิเล็กตรอนออกไปแล้วกลายเป็นไอออนที่มีประจุไฟฟ้าเป็นบวก เช่น โซเดียม ( 1123Na) จัดเรียงอิเล็กตรอนเป็น 2, 8, 1 เมื่อเกิดปฏิกิริยาจะจ่างเวเลนซ์อิเล็กตรอนออกไป 1 ตัวกลายเป็นโซเดียมไอออน (Na+) ซึ่งการจัดเรียงอิเล็กตรอนเป็น 2, 8 ไอออนที่เกิดใหม่มีจำนวนเวเลนซ์อิเล็กตรอนเท่ากับ 8 ตัวตามกฎออกเตต
กลุ่มธาตุอโลหะ
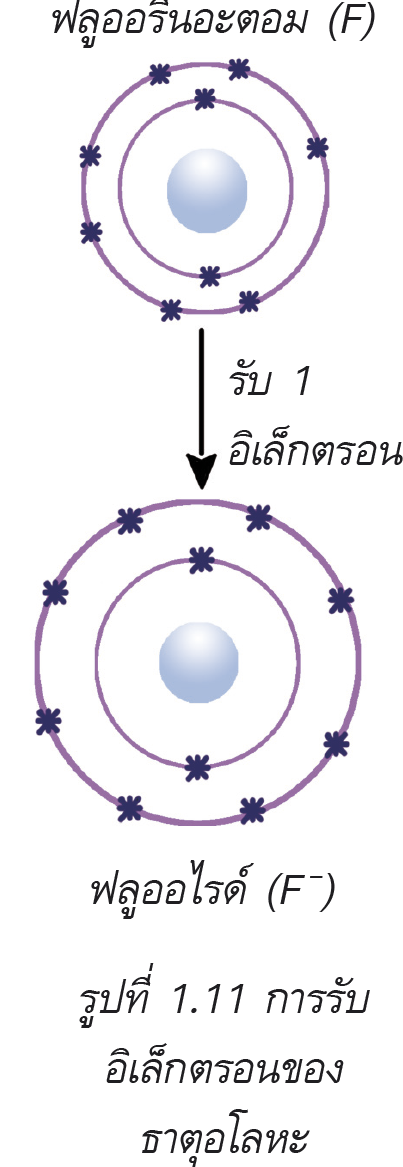
ธาตุที่มีสมบัติเป็นอโลหะ (non-metal) เป็นธาตุที่มีแนวโน้มในการดึงดูดเวเลนซ์อิเล็กตรอนจากอะตอมอื่นเข้ามาในอะตอมตัวเอง แล้วกลายเป็นไอออนที่มีประจุเป็นลบ ฟลูออรีน ( 199F) ที่มีการจัดเรียงอิเล็กตรอนเป็น 2, 7 เมื่อเกิดปฏิกิริยาจะรับอิเล็กตรอนเข้ามา 1 ตัว กลายเป็นฟลูออไรด์ (F-) ไอออนที่เกิดใหม่มีจำนวนเวเลนซ์อิเล็กตรอนเท่ากับ 8 ตัวตามกฎออกเตต
ธาตุที่มีเวเลนซ์อิเล็กตรอนเท่ากับ 8 ก็มีสมบัติเป็นอโลหะเช่นกัน แต่ธาตุชนิดนี้มีความเสถียรมาก เพราะมีเวเลนซ์อิเล็กตรอนครบ 8 ตัว จึงไม่ไวต่อการเกิดปฏิกิริยา
ตอนที่ 2 ตารางธาตุ
ผังมโนทัศน์สาระการเรียนรู้
สาระสำคัญ
1. ตารางธาตุเกิดจากการจัดเรียงธาตุโดยอาศัยเลขอะตอมและสมบัติที่คล้ายกันให้เป็นหมวดหมู่
2. ตารางธาตุใช้ทำนายแนวโน้มสมบัติหรือการเกิดปฏิกิริยาของธาตุในหมู่เดียวกันได้อย่างมีเหตุผล
3. ธาตุที่อยู่ในแนวดิ่งทั้ง 18 หมู่ แบ่งเป็นกลุ่มย่อย A 8 หมู่ เรียกว่า ธาตุรีพรีเซนเตตีฟ และกลุ่มย่อย B 10 หมู่ อยู่ตรงกลางตาราง เรียกว่า โลหะแทรนซิชัน
4. จำนวนเวเลนซ์อิเล็กตรอนสามารถใช้เป็นเกณฑ์ในการบอกเลขที่หมู่ของธาตุในหมู่ 1A - 8A ได้ ซึ่งธาตุในหมู่เดียวกันจะมีแนวโน้มของสมบัติคล้ายกัน
5. จำนวนเวเลนซ์อิเล็กตรอนที่มีได้มากที่สุดในคาบจะเท่ากับจำนวนธาตุที่มีในคาบนั้น ๆ และธาตุที่อยู่คาบเดียวกันจะมีจำนวนระดับพลังงานเท่ากัน
6. ธาตุในหมู่ 1A และหมู่ 2A มีสมบัติเป็นโลหะ ซึ่งจะมีความไวต่อการเกิดปฏิกิริยามากขึ้นตามจำนวนคาบที่เพิ่มขึ้น
7. ธาตุในหมู่ 3A 4A และ 6A เป็นกลุ่มธาตุกึ่งโลหะ ส่วนใหญ่เป็นสารกึ่งตัวนำที่สามารถนำไฟฟ้าได้เมื่ออุณหภูมิสูงขึ้น และเมื่ออุณหภูมิลดลงการนำไฟฟ้าก็จะลดลง
8. ธาตุในหมู่ 7A มีสมบัติเป็นอโลหะ ซึ่งความไวในการเกิดปฏิกิริยามีแนวโน้มลดลงเมื่อจำนวนคาบเพิ่มขึ้น
9. ธาตุในหมู่ 8A มีสมบัติเป็นอโลหะและอยู่ในสถานะแก๊สที่มีความเสถียรมาก
10. โลหะแทรนซิชันมีสมบัติทางกายภาพส่วนใหญ่เหมือนโลหะ แต่ไม่จัดเป็นธาตุในกลุ่มเดียวกับ 1A - 3A เพราะมีสมบัติทางเคมีบางอย่างแตกต่างกัน
Keywords
ตารางธาตุ : จัดธาตุที่มีสมบัติคล้ายกันออกเป็นช่วงตาราง
โลหะแอลคาไล : ธาตุในหมู่ 1A
โลหะแอลคาไลน์เอิร์ท : ธาตุในหมู่ 2A
ธาตุเรพรีเซนเตตีฟ : ธาตุในหมู่ย่อย A ทั้งหมด
ธาตุฮาโลเจน : ธาตุในหมู่ 7A
โลหะแทรนซิชัน : ธาตุที่สามารถเกิดเป็นไอออนบวกได้หลายค่า
วิวัฒนาการของตารางธาตุ
ดิมิตรี อีวาโนวิช เมนเดเลเยฟ (Dimitri Ivanovich Mendelejev) นักวิทยาศาสตร์ชาวรัสเซีย

สังเกตพบว่า หากจัดเรียงธาตุตามมวลอะตอมจากน้อยไปมาก จะสามารถจัดธาตุที่มีสมบัติคล้ายกันออกเป็นช่วงตารางได้ เรียกว่า ตารางธาตุ (periodic table)
ตารางแสดงธาตุของเมนเดเลเยฟ
|
คาบ |
หมู่ 1 |
หมู่ 2 |
หมู่ 3 |
หมู่ 4 |
หมู่ 5 |
หมู่ 6 |
หมู่ 7 |
หมู่ 8 |
|
คาบ 1 คาบ 2 คาบ 3
คาบ 4
คาบ 5 |
H Li Na
K Cu Rb Ag |
Be Mg Ca Zn Sr Cd |
B Al * * Y In |
C Si Ti * Zr Sn |
N P V As Nb Sb |
O S
Se Mo Te |
F Cl Mn Br * I |
Fe, Co, Ni
Ru, Rh, Pd |
ตารางธาตุที่เมนเดเลเยฟเสนอในครั้งแรกยังมีช่องที่ว่างเว้นไว้ซึ่งเป็นตำแหน่งของธาตุที่ยังไม่ถูกค้นพบในเวลานั้น แต่เมนเดเลเยฟก็ได้ตั้งชื่อและทำนายสมบัติของธาตุเหล่านั้นไว้ก่อน ต่อมา เฮนรี โมสลีย์ (Henry Moseley) นักวิทยาศาสตร์ชาวอังกฤษได้พบข้อบกพร่องบางประการในตารางธาตุของเมนเดเลเยฟ เช่น เมื่อจัดเรียงอะตอมจากน้อยไปหามากจะทำให้ธาตุบางธาตุในหมู่เดียวกันมีสมบัติไม่สอดคล้องกัน โมสลีย์มีแนวคิดว่าตำแหน่งของธาตุในตารางธาตุน่าจะขึ้นอยู่กับสมบัติที่มีความสัมพันธ์กับเลขอะตอม ดังนั้นเขาจึงจัดเรียงธาตุตามเลขอะตอมจากน้อยไปมาก และจัดธาตุที่มีสมบัติคล้ายกันอยู่ในแถวหรือหมู่เดียวกัน
ตารางธาตุในปัจจุบัน
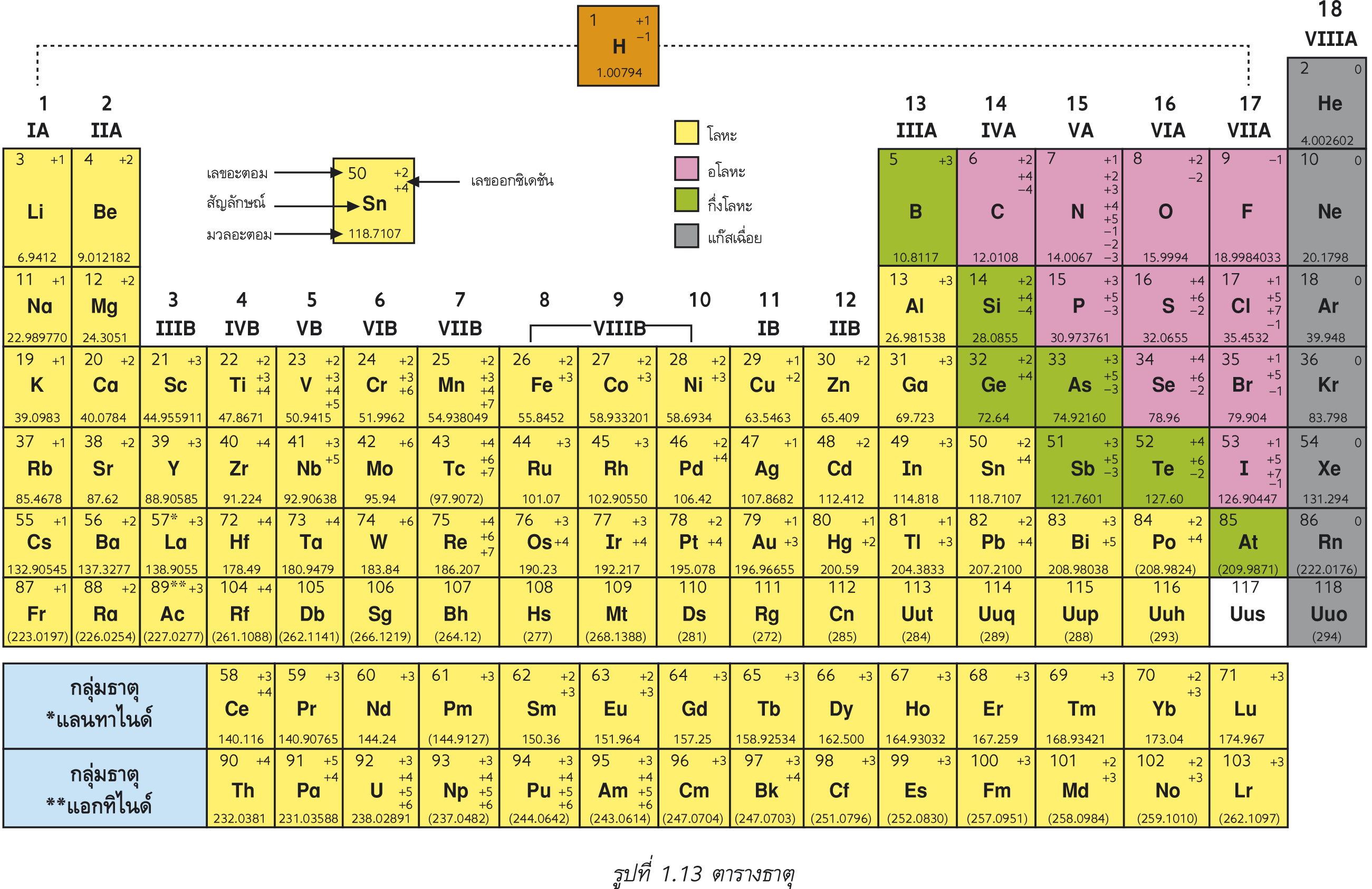
ปัจจุบันมีการใช้ตารางธาตุที่จัดธาตุตามเลขอะตอมจากน้อยไปมาก โดยแบ่งธาตุออกเป็น 18 หมู่ ในแนวดิ่ง และเป็น 7 คาบ ในแนวนอน ตามสมบัติทางเคมีและสมบัติทางกายภาพ
ธาตุทั้ง 18 หมู่ในแนวดิ่ง แบ่งออกเป็นกลุ่มย่อย A จำนวน 8 หมู่ และกลุ่มย่อย B จำนวน10 หมู่ ในหมู่ซ้ายสุดของตารางธาตุ ได้แก่ 1A และ 2A มีสมบัติเป็นโลหะ ส่วนด้านขวาคือ 7A และ 8A มีสมบัติเป็นอโลหะ ขณะที่ธาตุในหมู่ 3A ถึง 6A ประกอบด้วยธาตุที่มีสมบัติเป็นอโลหะและกึ่งโลหะ (metalloid) เรียกธาตุในหมู่ย่อย A ทั้งหมดว่า ธาตุเรพรีเซนเตตีฟ (representative elements) สำหรับธาตุกลุ่ม B ทั้ง 8 หมู่ที่อยู่ตรงกลางของตารางธาตุเรียกว่า โลหะแทรนซิชัน ส่วนธาตุที่อยู่ในแนวนอนมีทั้งหมด 7 แถว จำแนกเป็น 7 คาบ แต่ละคาบจัดเรียงธาตุตามเลขอะตอมที่เพิ่มขึ้น ทั้งนี้ ธาตุที่เป็นโลหะ อโลหะ และกึ่งโลหะจะมีสมบัติแตกต่างกันไป โดยธาตุที่อยู่ในหมู่เดียวกันจะแสดงแนวโน้มของสมบัติเหมือนกัน
ความสัมพันธ์ของธาตุในตารางธาตุ
ความสัมพันธ์ของธาตุในหมู่
เมื่อจัดเรียงอิเล็กตรอนของธาตุ พบว่าธาตุในหมู่เดียวกันจะมีจำนวนเวเลนซ์อิเล็กตรอนเท่ากัน
ตารางแสดงการจัดเรียงอิเล็กตรอนในอะตอมของธาตุหมู่ต่าง ๆ
|
หมู่ |
ธาตุ |
สัญลักษณ์ธาตุ
|
เลขอะตอม |
การจัดเรียงอิเล็กตรอนตามระดับพลังงาน
|
จำนวนเวเลนซ์อิเล็กตรอน
|
|
1A 2A 3A 4A 5A 6A 7A 8A |
ลิเทียม แมกนีเซียม โบรอน ซิลิคอน อาร์เซนิก (สารหนู) ซัลเฟอร์ (กำมะถัน) คลอรีน คริปทอน |
Li Mg B Si As S Cl Kr |
3 12 5 14 33 16 17 36 |
2, 1 2, 8, 2 2, 3 2, 8, 4 2, 8, 18, 5 2, 8, 6 2, 8, 7 2, 8, 18, 8 |
1 2 3 4 5 6 7 8 |
จากตาราง เมื่อจัดเรียงอิเล็กตรอนของธาตุในหมู่ต่าง ๆ จะพบว่ามีจำนวนอิเล็กตรอนเท่ากับเลขที่ของหมู่นั้น ดังนั้นเราจึงสามารถใช้จำนวนเวเลนซ์อิเล็กตรอนเป็นเกณฑ์บอกเลขที่หมู่ของธาตุในหมู่ 1A - 8A ได้
นอกจากนี้ยังพบว่า ธาตุที่มีจำนวนเวเลนซ์อิเล็กตรอนเท่ากันอยู่ในหมู่เดียวกันจะมีสมบัติคล้ายกัน
ความสัมพันธ์ของธาตุในคาบ
จำนวนอิเล็กตรอนที่มีได้มากที่สุดในแต่ละคาบจะเท่ากับจำนวนธาตุที่มีในคาบนั้น ๆ และธาตุที่อยู่คาบเดียวกันจะมีจำนวนระดับพลังงานเท่ากัน เช่น ธาตุในคาบที่ 1 มีจำนวนธาตุในคาบ 2 ธาตุ คือ H และ He จะมีจำนวนอิเล็กตรอนที่มีได้มากที่สุดในคาบเท่ากับ 2 และมีจำนวนระดับพลังงานเท่ากันคือ 1 ส่วนคาบที่ 2 มีจำนวนธาตุในคาบเท่ากับ 8 และมีจำนวนระดับพลังงานเท่ากันคือ 2 ส่วนธาตุในคาบที่ 6 และ 7 มีจำนวนคาบในธาตุ 32 ธาตุ จะมีจำนวนอิเล็กตรอนในคาบได้มากที่สุดเท่ากับ 32 และมีจำนวนระดับพลังงานเท่ากันคือ 6 และ 7 ตามลำดับ และเนื่องจากในคาบที่ 6 หลังธาตุแลนทานัม ( 57139La) ที่มีเลขอะตอม 57 นอกจากนี้ยังมีธาตุอีก 14 ธาตุที่มีเลขอะตอม 58–71 อยู่ด้วย เรียกว่า กลุ่มธาตุแลนทาไนด์ เช่นเดียวกับในคาบที่ 7 และหลังธาตุแอกทิเนียม ( 89227Ac) ทีมีเลขอะตอม 89 มีธาตุอีก 14 ธาตุ ซึ่งมีเลขอะตอม 90–103 อยู่ด้วย เรียกว่า กลุ่มธาตุแอกทิไนด์ ทำให้จำนวนธาตุในคาบที่ 6 และ 7 มี 32 ธาตุนั่นเอง
สมบัติของธาตุ
ธาตุหมู่ 1A และ 2A
ธาตุในหมู่ 1A และ 2A มีสมบัติเป็นโลหะ สมบัติทางกายภาพโดยทั่วไปสามารถนำไฟฟ้าและนำความร้อนได้ดี เป็นมันเงา และดึงหรือยืดเป็นเส้นลวดได้
ธาตุหมู่ 1A หรือ โลหะแอลคาไล (alkali metal) เป็นธาตุที่มีความเป็นโลหะมากที่สุด ธาตุในหมู่ 1A นี้จะไวต่อการเกิดปฏิกิริยามาก เช่น สามารถเกิดปฏิกิริยารุนแรงกับน้ำทำให้เกิดสารละลายเบสและแก๊สไฮโดรเจน นอกจากนี้ยังทำปฏิกิริยากับออกซิเจนในอากาศจนได้ผลิตภัณฑ์ที่เรียกว่า ออกไซด์ของโลหะ ซึ่งเมื่อละลายน้ำแล้วจะได้สารละลายที่มีสมบัติเป็นเบส
ทั้งนี้ ความไวในการเกิดปฏิกิริยาของธาตุมีแนวโน้มมากขึ้นตามจำนวนคาบ เนื่องจากระดับพลังงานที่เพิ่มขึ้นทำให้เวเลนซ์อิเล็กตรอนอยู่ห่างนิวเคลียสมากขึ้น แรงดึงดูดจากนิวเคลียสจึงลดลง ทำให้เวเลนซ์อิเล็กตรอนหลุดจากอะตอมได้ง่ายขึ้น
ธาตุหมู่ 2A หรือ โลหะแอลคาไลน์เอิร์ท (alkaline earth) อะตอมของโลหะในหมู่นี้จะมีขนาดเล็กและมีมวลน้อยกว่าหมู่ 1A จึงมีความหนาแน่นสูงกว่า สำหรับการทำปฏิกิริยาจะทำได้ช้ากว่าโลหะหมู่1A โดยจะเกิดปฏิกิริยาในน้ำร้อนทำให้ได้แก๊สไนโดรเจนและไฮดรอกไซด์คล้ายโลหะในหมู่ 1A ส่วนด้านความไวในการเกิดปฏิกิริยาของธาตุมีแนวโน้มเหมือนธาตุในหมู่ 1A คือเพิ่มตามจำนวนคาบ
ธาตุหมู่ 3A เป็นธาตุกึ่งโลหะที่มีสมบัติบางประการคล้ายธาตุในหมู่ 1A และ 2A แต่มีลักษณะพิเศษคือ ธาตุที่อยู่ภายในหมู่เดียวกันจะมีสมบัติต่างกัน เช่น ธาตุโบรอนและธาตุอะลูมิเนียมจะมีสมบัติกึ่งโลหะมากกว่าธาตุแกลเลียม ธาตุอินเดียม และธาตุแทลเลียมที่มีสมบัติเป็นโลหะ
ธาตุหมู่ 4A แต่ละธาตุจะมีสมบัติแตกต่างกันทั้งในด้านขนาดของอะตอม จุดหลอมเหลว ตลอดจนสมบัติทางเคมีบางอย่าง กล่าวคือ ธาตุคาร์บอนมีสมบัติเป็นอโลหะ ธาตุซิลิคอนมีลักษณะบางประการเป็นอโลหะแต่นำไฟฟ้าได้ ธาตุเจอร์เมเนียมมีสมบัติกึ่งโลหะ ส่วนธาตุดีบุกและธาตุตะกั่วมีสมบัติเป็นโลหะ
ธาตุหมู่ 5A และ 6A ประกอบด้วยธาตุบางส่วนที่มีสมบัติเป็นอโลหะ และบางธาตุที่มีสมบัติเป็นกึ่งโลหะ
ธาตุหมู่ 7A เรียกอีกชื่อหนึ่งว่า ธาตุแฮโลเจน (halogen) มีสมบัติเป็นอโลหะ ความไวในการเกิดปฏิกิริยาของธาตุอโลหะ มีแนวโน้มลดลงเมื่อจำนวนคาบเพิ่มขึ้น เนื่องจากเมื่อเกิดปฏิกิริยาธาตุในหมู่นี้จะดึงอิเล็กตรอนเข้ามา สำหรับอะตอมที่มีจำนวนระดับพลังงานน้อย โปรตอนในนิวเคลียสจะสามารถดึงดูดอิเล็กตรอนเข้าหาอะตอมได้ดี ส่วนอะตอมที่มีจำนวนระดับพลังงานสูง แม้ว่าจะมีจำนวนโปรตอนเพิ่มขึ้น แต่ระดับพลังงานที่เพิ่มอาจบดบังแรงดึงดูดของโปรตอนได้
ธาตุหมู่ 8A ทั้งหมดเป็นแก๊ส เรียกว่า แก๊สเฉื่อย (inert gas) ที่มีความเสถียรมาก เพราะมีจำนวนเวเลนซ์อิเล็กตรอนเท่ากับ 8 ตัวซึ่งครบเต็มตามจำนวนอิเล็กตรอนมากที่สุดที่มีได้ในระดับพลังงานชั้นนอกสุด
โลหะแทรนซิชัน
โลหะแทรนซิชัน ได้แก่ ธาตุในหมู่ B ทั้งหมด รวมทั้งธาตุในกลุ่มแลนทาไนด์และกลุ่มแอกทิไนด์ สมบัติทางกายภาพส่วนใหญ่เหมือนกับโลหะ โลหะแทรนซิชันในหมู่และในคาบเดียวกันจะมีสมบัติทางเคมีและทางกายภาพคล้ายกัน โดยเฉพาะในกลุ่มแลนทาไนด์และกลุ่มแอกทิไนด์ที่คล้ายกันจนไม่อาจแบ่งหมู่ได้อีก และด้วยลักษณะของโหะทรานซิชันที่สามารถเกิดเป็นไอออนบวกได้หลายค่า ทำให้เกิดสารประกอบเชิงซ้อนที่หลากหลายและมีสีสันเฉพาะตัว เช่น ด่างทับทิม (KMnO4) มีสีชมพูอมม่วง โพแทสเซียมไดโครเมต (K2Cr2O7) มีสีส้ม และนิกเกิล (II) ซัลเฟต (NiSO46H2O) มีสีเหลือง
ตอนที่ 3 พันธะเคมี
ผังมโนทัศน์สาระการเรียนรู้
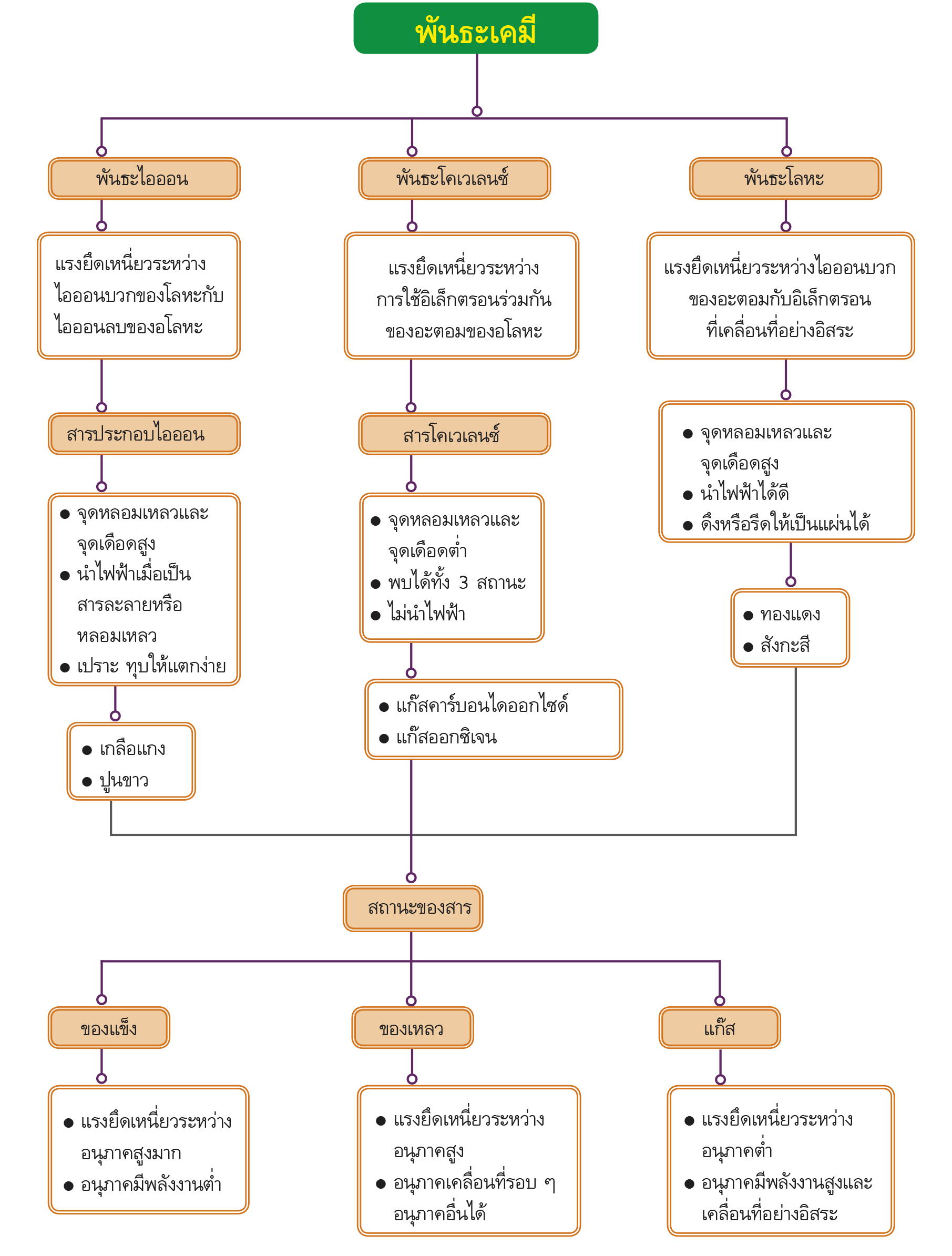
สาระสำคัญ
1. พันธะเคมี คือ แรงยึดเหนี่ยวที่ทำให้อะตอมหรือไอออนของธาตุอยู่รวมกันเป็นโมเลกุล
2. พันธะไอออนเกิดจากแรงยึดเหนี่ยวระหว่างอะตอมของโลหะกับอโลหะรวมกันเป็นผลึก โดยอะตอมของโลหะจะเป็นฝ่ายให้เวเลนซ์อิเล็กตรอน ส่วนอะตอมของอโลหะจะเป็นฝ่ายรับอิเล็กตรอน
3. สารที่เกิดจากแรงยึดเหนี่ยวกันด้วยพันธะไอออนเรียกว่า สารประกอบไอออน
4. จุดเดือดและจุดหลอมเหลวของสารประกอบไอออนมีค่าสูงมากเนื่องจากมีแรงดึงดูดทางไฟฟ้าที่แข็งแรง
5. พันธะโคเวเลนซ์เกิดจากการใช้เวเลนซ์อิเล็กตรอนร่วมกันเป็นคู่ ๆ ของอะตอมโดยไม่มีการถ่ายโอนอิเล็กตรอน
6. สารที่เกิดจากการยึดเหนี่ยวกันด้วยพันธะโคเวเลนซ์เรียกว่า สารโคเวเลนซ์
7. จุดเดือดและจุดหลอมเหลวของสารโคเวเลนซ์มีค่าต่ำ
8. พันธะโลหะเป็นแรงยึดเหนี่ยวระหว่างไอออนบวกของอะตอมกับอิเล็กตรอนที่เคลื่อนที่อย่างอิสระ
9. จุดเดือดและจุดหลอมเหลวของสารที่เกิดจากพันธะโลหะมีค่าสูง เพราะอะตอมทุกตัวยึดเหนี่ยวกันอย่างแข็งแรงด้วยพันธะโลหะ
10. สถานะของสารขึ้นอยู่กับแรงยึดเหนี่ยวระหว่างอนุภาคของสาร
11. อนุภาคของของแข็งมีพลังงานต่ำที่สุด โมเลกุลเคลื่อนที่ช้ามาก จึงถูกยึดกันไว้อย่างแข็งแรงด้วยแรงยึดเหนี่ยวระหว่างโมเลกุล
12. ของเหลวมีค่าพลังงานในโมเลกุลต่ำกว่าแก๊สแต่สูงกว่าของแข็ง ทำให้แรงยึดเหนี่ยวระหว่างโมเลกุลมีค่าน้อยกว่าของแข็ง การเคลื่อนที่ของโมเลกุลจึงมีอิสระมากกว่า
13. แก๊สเป็นสถานะที่มีพลังงานมากที่สุด โมเลกุลของแก๊สจึงเคลื่อนที่ได้อย่างอิสระมากกว่าของแข็งและของเหลว แรงยึดเหนี่ยวระหว่างโมเลกุลจึงมีน้อยมากเมื่อเทียบกับสถานะอื่น
Keywords
พันธะเคมี : การยึดเหนี่ยวกันของอะตอมเป็นโมเลกุล
พันธะไอออนิก : พันธะที่ยึดเหนี่ยวระหว่างประจุบวกของอะตอมโลหะกับประจุลบของอะตอมอโลหะ
พันธะโคเวเลนซ์ : การเกิดพันธะโดยใช้เวเลนซ์อิเล็กตรอนร่วมกันเป็นคู่ ๆ
พันธะโลหะ : แรงยึดเหนี่ยวระหว่างไอออนบวกของอะตอมกับอิเล็กตรอนที่เคลื่อนที่อย่างอิสระ
พันธะเคมี
สารส่วนใหญ่เกิดจากอะตอมที่รวมกันเป็นกลุ่ม (ยกเว้นธาตุในหมู่ 8A) โดยยึดกันเป็นกลุ่มของอะตอมจำนวนมากกว่าหนึ่ง เรียกว่า โมเลกุล แรงยึดเหนี่ยวระหว่างอะตอมในโมเลกุลเรียกว่า พันธะเคมี (chemical bond) ธาตุโลหะ อโลหะ และกึ่งโลหะ จะมีแรงยึดเหนี่ยวที่แตกต่างกันไป แบ่งได้ 3 ชนิด คือ พันธะไอออนิก (ionic bond) พันธะโคเวเลนซ์ (covalent bond) และพันธะโลหะ (metallic bond) พันธะที่แตกต่างกันจะส่งผลให้สมบัติทางกายภาพบางอย่างแตกต่างกัน
พันธะไอออนิก
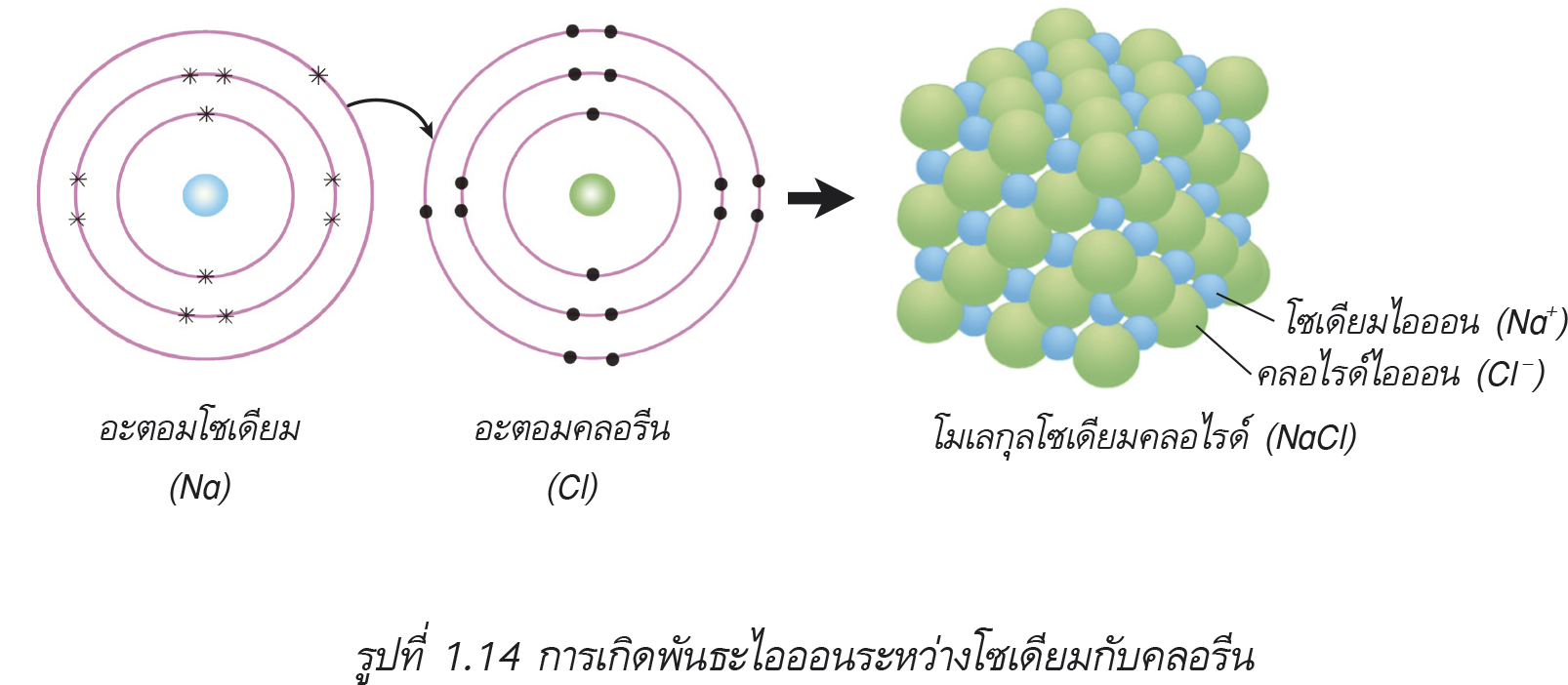
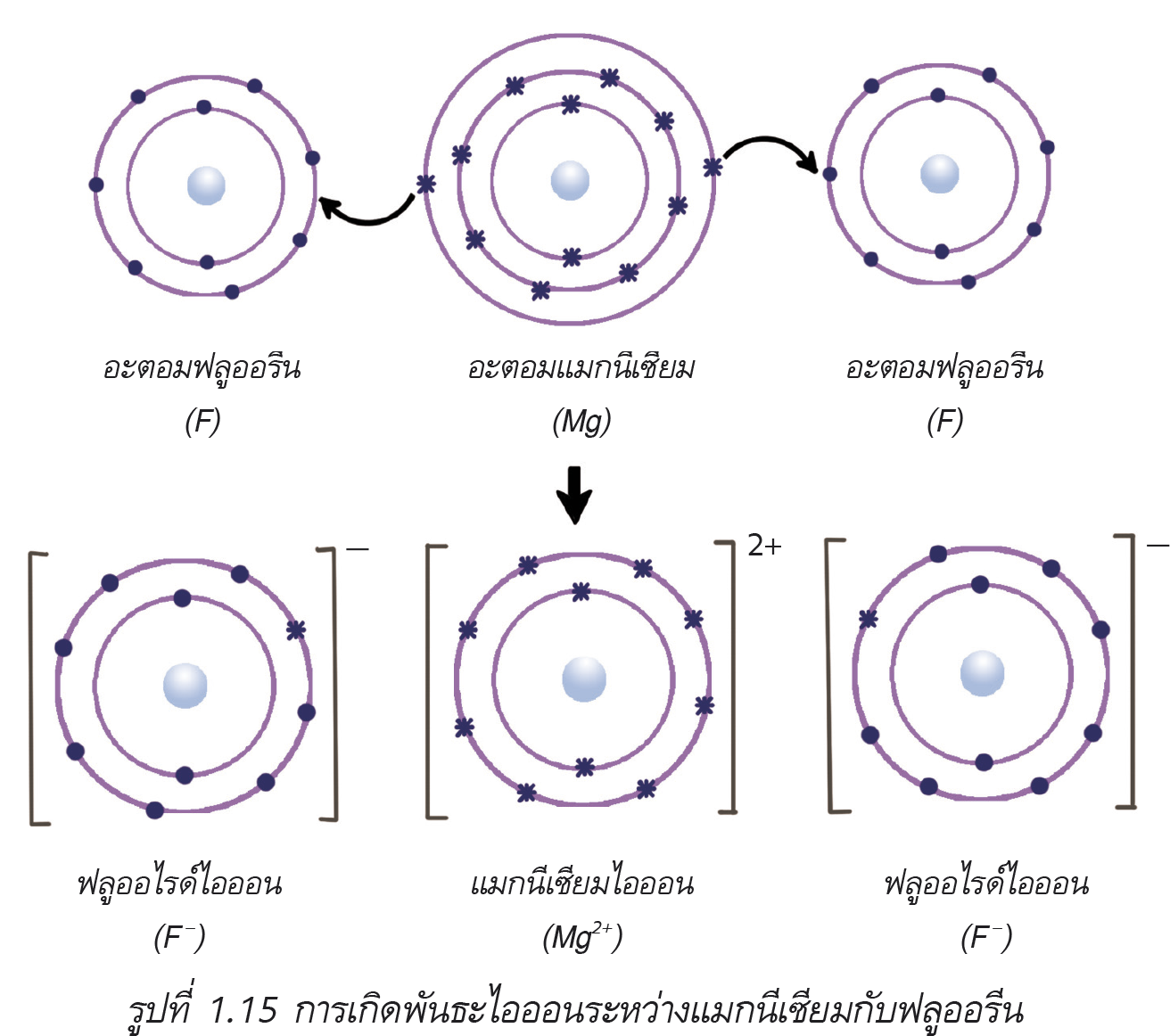
พันธะไอออนิกเป็นพันธะที่ยึดเหนี่ยวระหว่างอะตอมของโลหะกับอโลหะรวมกันเป็น เช่น พันธะไอออนิกของเกลือแกง (NaCl) ซึ่งมีกระบวนการคือ โซเดียมจะให้เวเลนซ์อิเล็กตรอนไป 1 ตัว กลายเป็นโซเดียมไอออน (Na+) ซึ่งมีประจุไฟฟ้าเป็นบวก ทำให้ Na+ มีจำนวนเวเลนซ์อิเล็กตรอนเท่ากับ 8 ตัว และคลอรีนรับอิเล็กตรอนมา 1 ตัวกลายเป็นคลอไรด์ไอออน (Cl-) ซึ่งมีประจุไฟฟ้าเป็นลบ ทำให้ Cl- มีจำนวนเวเลนซ์อิเล็กตรอนเท่ากับ 8 ตัว ไอออนทั้งสองที่มีประจุไฟฟ้าต่างกันจึงยึดเหนี่ยวกันด้วยแรงดึงดูดระหว่างประจุไฟฟ้าเกิดเป็นพันธะไอออนิก สารที่เกิดจากการยึดเหนี่ยวกันด้วยพันธะชนิดนี้เรียกว่า สารประกอบไอออนิก
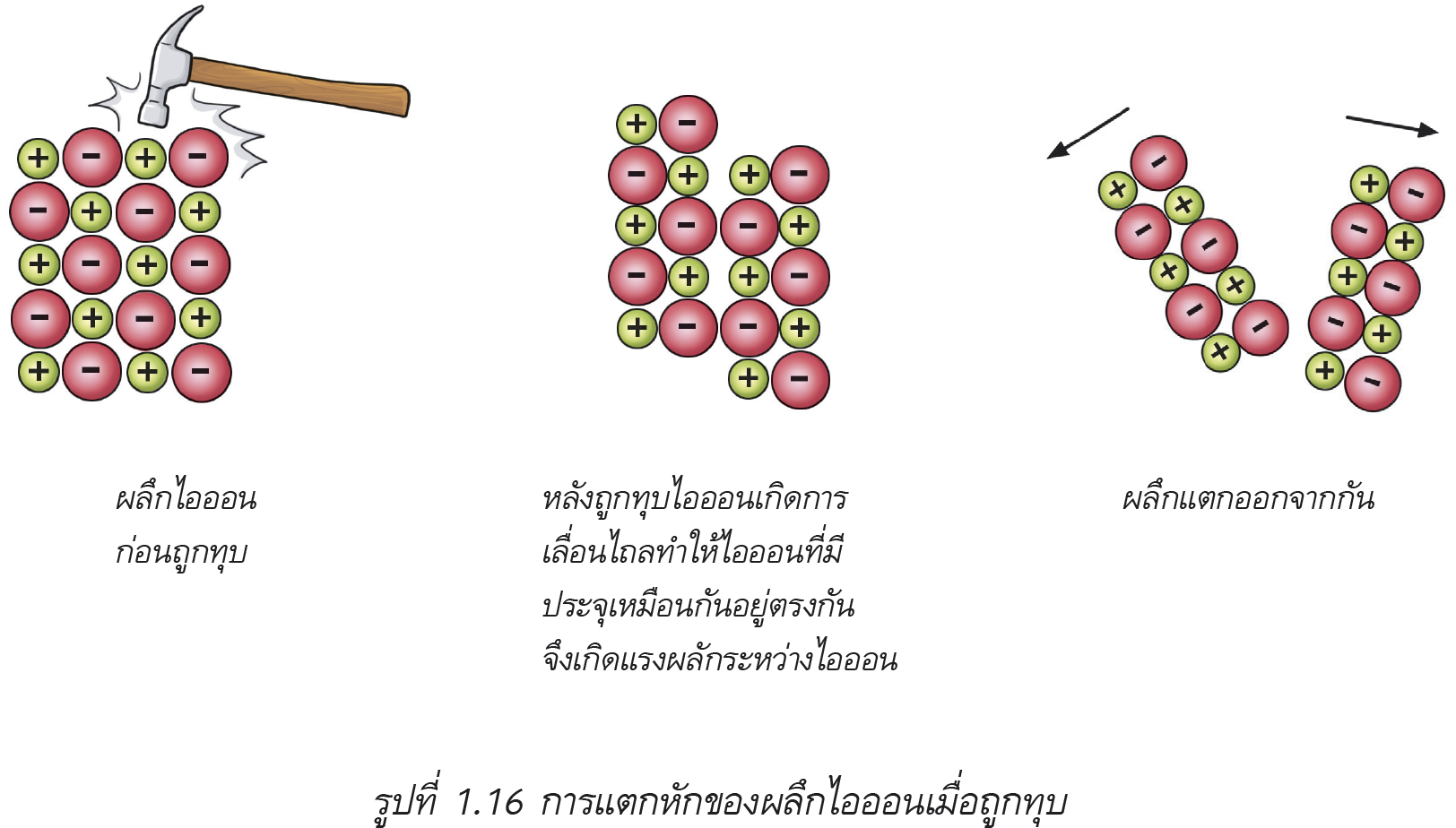
สารประกอบไอออนิกมีจุดเดือดและจุดหลอมเหลวสูง เนื่องจากยึดเหนี่ยวกันด้วยแรงดึงดูดทางไฟฟ้าที่แข็งแรง การลดหรือทำลายพันธะดังกล่าวจึงต้องใช้พลังงานปริมาณสูง สารประกอบไอออนิกบางชนิดสามารถละลายน้ำได้ดี เพราะแรงยึดเหนี่ยวระหว่างโมเลกุลของน้ำกับไอออนมีค่ามากกว่าแรงยึดเหนี่ยวระหว่างไอออนบวกกับไอออนลบในสารประกอบไอออนิก นอกจากนี้สารประกอบไอออนยังเป็นสารที่เปราะ เมื่อทุบจึงแตกหักได้ง่าย เพราะขณะที่ทุบ ผลึกของสารประกอบไอออนจะเลื่อนไปตามระนาบผลึก ไอออนชนิดเดียวกันจะเลื่อนไปตรงกันและเกิดแรงผลักกัน ส่งผลให้ผลึกแตกออก
พันธะโคเวเลนซ์
พันธะโคเวเลนซ์เกิดจากการที่อะตอมใช้เวเลนซ์อิเล็กตรอนร่วมกันเป็นคู่ ๆ สารที่ได้เรียกว่า สารโคเวเลนซ์ ซึ่งจากการศึกษาพบว่า ธาตุที่ยึดเหนี่ยวกันด้วยพันธะโคเวเลนซ์ส่วนใหญ่เป็นธาตุประเภทอโลหะ
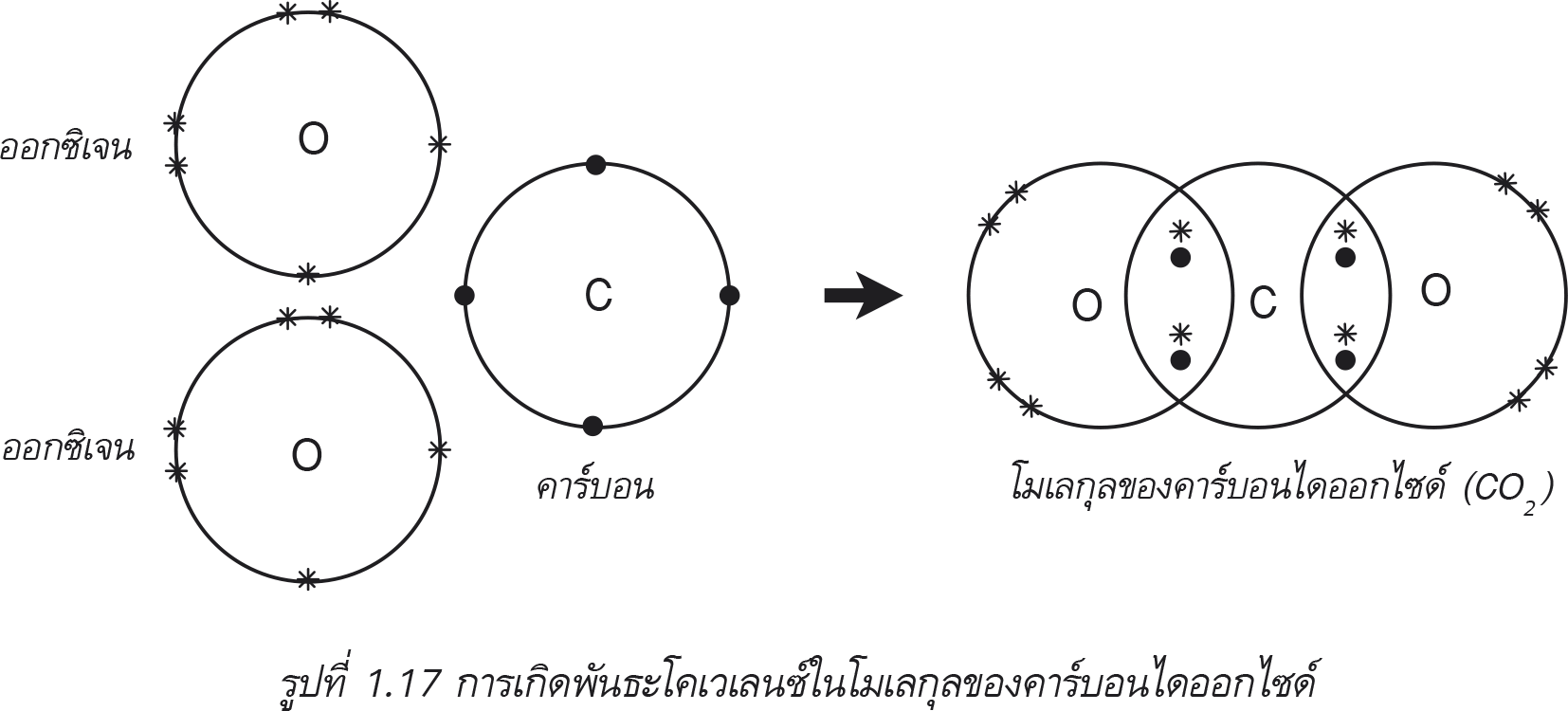
ตัวอย่างโมเลกุลคาร์บอนไดออกไซด์ คาร์บอน 1 อะตอมมีเวเลนซ์อิเล็กตรอน 4 ตัว จึงสามารถรับอิเล็กตรอนได้อีก 4 ตัวเพื่อให้ครบ 8 ตัวตามกฎออกเตต ส่วนออกซิเจนมีเวเลนซ์อิเล็กตรอน 6 ตัว จึงรับอิเล็กตรอนได้อีก 2 ตัว และออกซิเจน 1 อะตอมใช้เวเลนซ์อิเล็กตรอนร่วมกับคาร์บอน 2 ตัว เรียกอิเล็กตรอนที่ใช้ร่วมกันนี้ว่า อิเล็กตรอนคู่ร่วมพันธะ (bonded pair electron)
ชนิดของพันธะโคเวเลนซ์
ชนิดของพันธะโคเวเลนซ์สามารถแบ่งตามการใช้จำนวนเวเลนซ์อิเล็กตรอนร่วมได้ 3 ชนิด คือ
1. พันธะเดี่ยว คือ พันธะที่เกิดจากการใช้เวเลนซ์อิเล็กตรอนร่วมกัน 1 คู่

2. พันธะคู่ คือ พันธะที่เกิดจากการใช้เวเลนซ์อิเล็กตรอนร่วมกัน 2 คู่
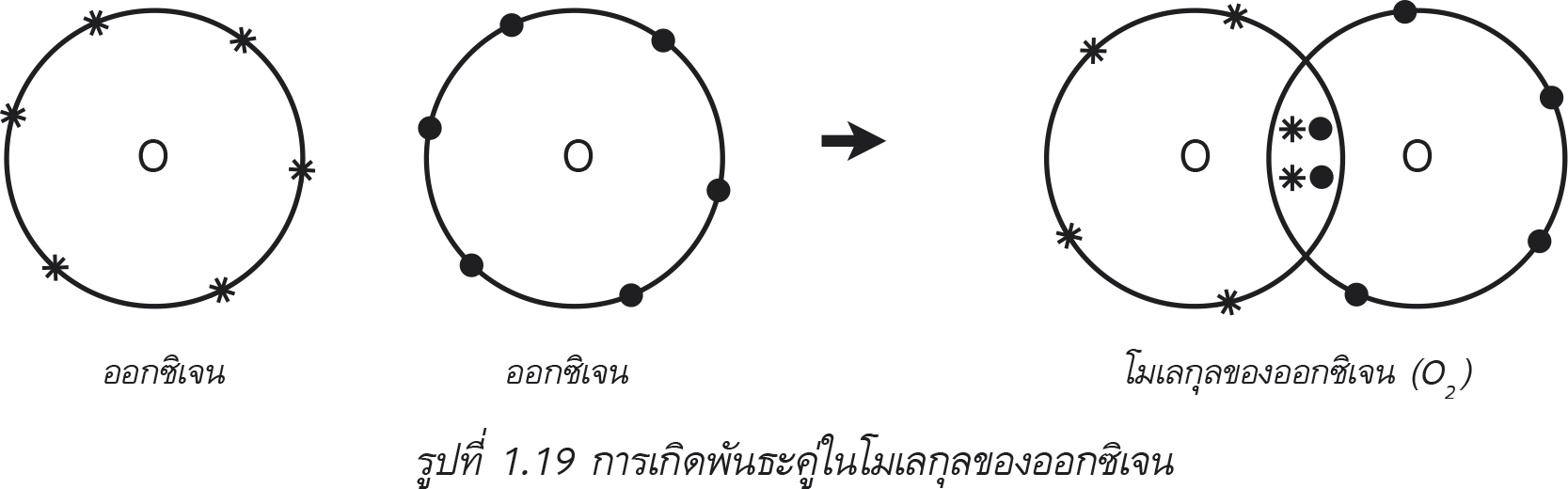
3. พันธะสาม คือ พันธะที่เกิดจากการใช้เวเลนซ์อิเล็กตรอนร่วมกัน 3 คู่

แรงยึดเหนี่ยวระหว่างโมเลกุลของสารโคเวเลนซ์ไม่ได้เกิดจากความแตกต่างของปะจุไฟฟ้าแบบสารประกอบไอออนิกเนื่องจากไม่มีการให้หรือรับเวเลนซ์อิเล็กตรอน ดังนั้นสารโคเวเลนซ์โดยทั่วไปจึงมีจุดหลอมเหลวและจุดเดือดต่ำ ทั้งนี้ เราสามารถพบสารโคเวเลนซ์ได้ทุกสถานะ ทั้งของแข็ง ของเหลว และแก๊ส ซึ่งขึ้นอยู่กับจุดเดือดและจุดหลอมเหลวของสารดังกล่าว
สารโคเวเลนซ์มีจุดหลอมเหลวและจุดเดือดสูง เนื่องจากอะตอมมีการสร้างพันธะยึดเหนี่ยวเป็นสามมิติหรือโครงสร้างคล้ายตาข่าย เรียกว่า สารโครงร่างผลึกตาข่าย เช่น เพชร แกรไฟต์ และซิลิกา
พันธะโลหะ
พันธะโลหะเป็นแรงยึดเหนี่ยวระหว่างไอออนบวกของอะตอมกับอิเล็กตรอนที่เคลื่อนที่อย่างอิสระจนเกิดเป็นแรงยึดเหนี่ยวที่แข็งแรง โลหะมีจุดเดือดและจุดหลอมเหลวสูงเพราะอะตอมยึดเหนี่ยวกันอย่างแข็งแรงด้วยพันธะโลหะทุกอะตอม การหลอมเหลวหรือการเดือดของโลหะจึงต้องใช้พลังงานสูงมาก

การที่เวเลนซ์อิเล็กตรอนของอะตอมโลหะเคลื่อนที่อย่างอิสระทำให้สามารถนำความร้อนและนำไฟฟ้าได้ทั่วทั้งก้อนโลหะ นอกจากนี้โลหะยังสามารถบิด งอ รีดเป็นแผ่น หรือดึงเป็นเส้นได้ เนื่องจากอะตอมเรียงตัวอย่างเป็นระเบียบ การทุบหรืองอแผ่นโลหะจะผลักชั้นของอะตอมให้เลื่อนไปจากตำแหน่งเดิม แต่อะตอมยังคงยึดเหนี่ยวกันอย่างแข็งแรง ทำให้ไม่เกิดการแตกหักเหมือนสารประกอบไอออนิก
สถานะกับแรงยึดเหนี่ยวระหว่างอนุภาคของสาร
ระหว่างโมเลกุลของสารจะมีแรงยึดเหนี่ยวทำให้สารอยู่ในสถานะต่าง ๆ คือ ของแข็ง (solid) ของเหลว (liquid) และแก๊ส (gas) ตามสภาพแวดล้อมในขณะนั้นซึ่งได้แก่ อุณหภูมิและความดัน ซึ่งปัจจัยสำคัญที่กำหนดสภาวะของสารคืออุณหภูมิ โดยอุณหภูมิจะทำให้เกิดอนุภาคพลังงานและส่งผลให้แรงยึดเหนี่ยวระหว่างโมเลกุลเปลี่ยนแปลงไป
ของแข็ง
ของแข็งเป็นสถานะที่สสารมีพลังงานต่ำสุด โมเลกุลซึ่งเคลื่อนที่ช้ามากจึงถูกยึดไว้อย่างแข็งแรงด้วยแรงยึดเหนี่ยวระหว่างโมเลกุล ส่งผลให้การเคลื่อนที่ของสารไม่เป็นอิสระ ในการทำให้ของแข็งเปลี่ยนสถานะจะต้องใช้อุณหภูมิเข้าไปเพิ่มพลังงานแก่โมเลกุลเกิดการหลอมเหลวเป็นของเหลว อุณหภูมิในระยะนี้เรียกว่า จุดหลอมเหลว (melting point) ในทางตรงข้าง หากของเหลวมีอุณหภูมิลดลง แรงยึดเหนี่ยวระหว่างโมเลกุลก็จะเพิ่มสูงขึ้นจนกลายเป็นของแข็ง เรียกอุณหภูมินี้ว่า จุดเยือกแข็ง (freezing point) สำหรับของแข็งผลึก (crystalline solid) เป็นของแข็งที่มีการจัดเรียงอนุภาคอย่างเป็นระเบียบจนเกิดผลึกที่มีรูปร่างทางเรขาคณิต ซึ่งจำแนกเป็น 4 ชนิด คือ ผลึกไอออนิก ผลึกโคเวเลนซ์ ผลึกโมเลกุล และผลึกโลหะ ตามพันธะเคมีหรือแรงยึดเหนี่ยวระหว่างโมเลกุลที่มีในผลึกดังกล่าว

ของเหลว
แรงยึดเหนี่ยวระหว่างโมเลกุลของของเหลวมีค่าน้อยกว่าของแข็ง การเคลื่อนที่ของโมเลกุลจึงมีอิสระมากกว่าของแข็ง ของเหลวและแก๊สสามารถเรียกรวมกันได้ว่าเป็นของไหล คือ ไม่แข็งคงรูปแต่สามารถเคลื่อนที่ได้ แรงยึดเหนี่ยวระหว่างโมเลกุลที่ต่างกันของของเหลวทำให้เกิดสมบัติของความหนาแน่น กล่าวคือ ถ้าโมเลกุลมีแรงยึดเหนี่ยวระหว่างกันมากก็จะเข้าใกล้กันมากขึ้น ทำให้ความหนาแน่นของของเหลวสูงหรือมีลักษณะหนืด ทั้งนี้ ความหนาแน่นจะแปรผกผันกับอุณหภูมิ หากอุณหภูมิสูงจะทำให้โมเลกุลมีพลังงานสูงและเคลื่อนที่ได้อย่างอิสระมากขึ้น ทำให้ความหนาแน่นลดลง
แก๊ส
แก๊สเป็นสถานะที่มีพลังงานมากที่สุด แรงยึดเหนี่ยวระหว่างโมเลกุลจะน้อยกว่าสถานะอื่น โมเลกุลของแก๊สจึงสามารถเคลื่อนที่ได้อย่างอิสระมากกว่าแข็งและของเหลว ปริมาตรของแก๊สอาจเปลี่ยนได้เสมอโดยฟุ้งกระจายอยู่เต็มพื้นที่ของภาชนะที่บรรจุ กล่าวคือ ปริมาตรของภาชนะที่บรรจุแก๊สก็คือปริมาตรของแก๊ส เมื่อลดอุณหภูมิของแก๊สจนอยู่ในระดับที่อนุภาคเคลื่อนที่เข้าใกล้กันมากขึ้น จนสร้างแรงยึดเหนี่ยวได้มากพอ แก๊สจะเปลี่ยนสถานะกลายเป็นของเหลว เรียกว่า การควบแน่น (condensation)

แหล่งที่มาของเนื้อหา : สำนักพิมพ์วัฒนาพานิช www.wpp.co.th

