การผลิตกระแสไฟฟ้า
กระแสไฟฟ้า เกิดจากการเคลื่อนที่ของอิเล็กตรอน โดยอิเล็กตรอนจะเคลื่อนที่จากจุดที่มีศักย์ไฟฟ้าต่ำผ่านลวดตัวนำไปยังจุดที่มีศักย์ไฟฟ้าสูง ทำให้เกิดกระแสไฟฟ้าเคลื่อนที่ในทิศทางตรงกันข้าม คือ จากจุดที่มีศักย์ไฟฟ้าสูงไปยังจุดที่มีศักย์ไฟฟ้าต่ำ
ค่าความต่างศักย์ มีหน่วยเป็นโวลต์ (V) เมื่อเกิดความต่างศักย์ระหว่างจุดสองจุดจะมีพลังงานผลักดันให้กระแสไฟฟ้าไหล
การผลิตกระแสไฟฟ้า อาจได้จากปฏิกิริยาเคมีหรือพลังงานกลก็ได้
ความรู้เกี่ยวกับเซลล์ไฟฟ้าเคมี
เซลล์ไฟฟ้าเคมี ทำหน้าที่เปลี่ยนรูปพลังงานเคมีไปเป็นพลังงานไฟฟ้า
ส่วนประกอบของเซลล์ไฟฟ้าเคมี ได้แก่ แผ่นโลหะที่ต่างกัน 2 ชนิด ทำหน้าที่เป็นขั้วไฟฟ้าขั้วบวกและขั้วลบ สารละลายที่นำไฟฟ้าได้ (อิเล็กโทรไลต์) ซึ่งจะมีไอออนบวกและไอออนลบ โดยจะต้องจุ่มแผ่นโลหะทั้ง 2 ชนิดลงในสารละลายที่นำไฟฟ้าได้
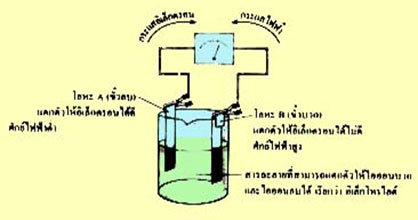
ภาพที่ 1 รูปแสดงส่วนประกอบของเซลล์ไฟฟ้าเคมี
หลักการสร้างเซลล์ไฟฟ้า
จุ่มแผ่นโลหะต่างกัน 2 ชนิด ลงในสารละลายที่แตกตัวให้ไอออนบวกและไอออนลบ โลหะต่างชนิดกันจะแตกตัวให้อิเล็กตรอนได้ต่างกัน ดังนั้นเมื่อต่อแผ่นโลหะทั้งสองเข้าด้วยกันโลหะที่แตกตัวให้อิเล็กตรอนดีกว่า จะมีศักย์ไฟฟ้าต่ำ เรียกว่า ขั้วลบ ส่วนโลหะที่เสียอิเล็กตรอนยากกว่าจะมีศักย์ไฟฟ้าสูงกว่า เรียกว่า ขั้วบวก อิเล็กตรอนจะไหลจากขั้วที่มีศักย์ไฟฟ้าต่ำไปยังขั้วที่มีศักย์ไฟฟ้าสูง ส่วนกระแสไฟฟ้าจะไหลจากขั้วที่มีศักย์ไฟฟ้าสูงไปยังขั้วที่มีศักย์ไฟฟ้าต่ำ กระแสไฟฟ้าจะไหลจนกระทั่งศักย์ไฟฟ้าที่ขั้วทั้งสองเท่ากัน จึงจะหยุดไหล แสดงว่าไฟหมด
เซลล์ไฟฟ้าเคมีที่ใช้แผ่นโลหะสังกะสีและแผ่นโลหะทองแดงจุ่มลงในสารละลายกรดซัลฟิวริก มีปฏิกิริยาเคมีเกิดขึ้น ดังนี้
ปฏิกิริยาที่แผ่นสังกะสี Zn(s) ----> Zn2+(aq) + 2e-
ปฏิกิริยาที่แผ่นทองแดง คือ 2H +(aq) + 2e- ----> H2(g)
ดังนั้นปฏิกิริยาที่เกิดขึ้นในเซลล์ไฟฟ้าเคมีชนิดนี้ คือ Zn(s)+2H+(aq) ----> Zn2+(aq) + H2(g)
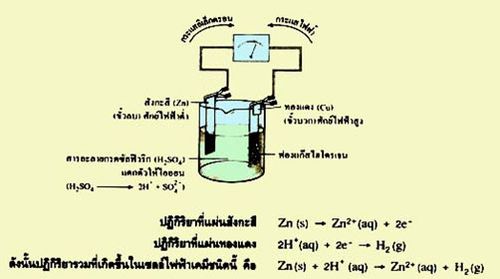
ภาพที่ 2 รูปแสดงการเกิดปฏิกิริยาในเซลล์ไฟฟ้าเคมี
เมื่อขั้วสังกะสีแตกตัวให้สังกะสีไอออน ( Zn2+) และอิเล็กตรอน อิเล็กตรอนจะไหลผ่านลวดตัวนำผ่านเครื่องวัดกระแสไฟฟ้าไปยังขั้วทองแดง Zn2+ จะอยู่ในสารละลาย สังกะสีจึงกร่อนไป ส่วน H+ จะเข้าไปรับอิเล็กตรอนที่แผ่นทองแดง จึงเกิดแก๊ส H2 เกาะอยู่ที่แผ่นทองแดง
ถ่านไฟฉาย
ถ่านไฟฉาย เป็นเซลล์ไฟฟ้าเคมีที่ไม่ใช้สารละลายที่เป็นของเหลว จึงเรียกว่า เซลล์แห้ง (Dry cell) ผู้ที่สร้างเซลล์ไฟฟ้าเคมีชนิดนี้คือ เลอคังเช ดังนั้นจึงอาจเรียกอีกชื่อหนึ่งว่า เซลล์เลอคังเช ถ่านไฟฉาย 1 ก้อนหรือ 1 เซลล์มีความต่างศักย์ประมาณ 1.5 โวลต์
ส่วนประกอบของถ่านไฟฉายและทิศทางการเคลื่อนที่ของกระแสอิเล็กตรอน
ถ่านไฟฉายเมื่อใช้ไปนาน ๆ ปฏิกิริยาเคมีจะเกิดน้อยลง ( ความต่างศักย์ลดลง ) เนื่องจากสารเคมีที่ใช้ทำปฏิกิริยาเคมีเหลือน้อยลง ขณะเกิดปฏิกิริยาเคมีจะมีน้ำเกิดขึ้น ดังนั้นเมื่อใช้งานไปนาน ๆ ถ่านไฟฉายจะบวม เยิ้ม เปียก แสดงว่า ถ่านเสื่อมสภาพ ควรเลิกใช้ เพราะมีสารที่เป็นอันตรายต่อร่างกาย
แมงกานีสไดออกไซด์ (NnO2) เป็นสารที่มีอันตราย ถ้าเข้าสู่ร่างกาย จะไปทำลายระบบประสาทของร่างกาย
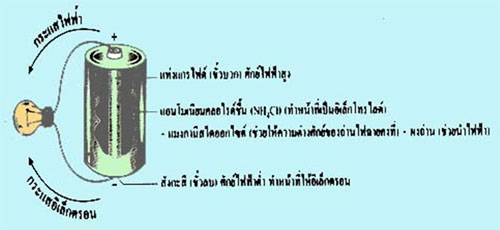
ภาพที่ 3 รูปแสดงส่วนประกอบของถ่านไฟฉาย
แบตเตอรี่
แบตเตอรี่ เป็นคำเรียกทั่วๆไป ใช้เรียกเซลล์ไฟฟ้าที่นำมาต่อกันแบบอนุกรมตั้งแต่ 2 เซลล์ขึ้นไป เช่น แบตเตอรี่รถยนต์ได้จากการนำเซลล์สะสมไฟฟ้าแบบตะกั่วซึ่งมีความต่างศักย๋เซลล์ละ 2 โวลต์ มาต่อกันแบบอนุกรม 6 เซลล์ ได้ความต่างศักย์รวม = 6 x 2 = 12 โวลต์
เซลล์สะสมไฟฟ้าแบบตะกั่ว (Lead Storage Cell)
1.ส่วนประกอบ ได้แก่ แผ่นตะกั่ว แผ่นตะกั่วออกไซต์สารละลายกรดซัลฟิวริก
2.ให้ความต่างศักย์ 2 โวลต์ กระแสไฟฟ้าจะไหลจากแผ่นตะกั่วออกไซด์ไปยังแผ่นตะกั่ว
3.เมื่อใช้ไปนาน ๆ จะเกิดตะกั่วซัลเฟต (PbSo4) จับที่ขั้วทั้งสอง ทำให้ไม่เกิดความต่างศักย์กระแสไฟฟ้าจึงหยุดไหล แต่สามารถนำไปประจุไฟฟ้าใหม่ ก็จะได้ตะกั่ว ตะกั่วออกไซต์ และกรดซัลฟิวริก ซึ่งนำมาใช้ได้อีก
4.การประจุไฟฟ้าให้ต่อขั้วลบเข้ากับขั้วลบ ขั้วบวกเข้ากับขั้วบวก
5.สารตะกั่วมีอันตราย เพราะไปทำลายเม็ดโลหิตแดงและระบบประสาทของร่างกาย ดังนั้นจึงต้องระวังทั้งในกระบวนการผลิต การใช้ และไม่ควรนำไปทิ้งในที่สาธารณะ

ภาพที่ 4 รูปแสดงส่วนประกอบของเซลล์สะสมไฟฟ้าแบบตะกั่ว
เซลล์แอลคาไล เซลล์เงิน เซลล์ปรอท
เซลล์แอลคาไล เซลล์เงิน เซลล์ปรอท มีขนาดเล็กมาก มีรูปร่างคล้ายเม็ดกระดุม ใช้กับนาฬิกาข้อมือ หูฟัง ซึ่งใช้งานได้นานกว่าถ่านไฟฉายธรรมดา
เซลล์ไฟฟ้าเคมี แบ่งออกเป็น 2 ชนิด คือ
1. เซลล์ปฐมภูมิ (Primary Cell) เมื่อใช้แล้วสารเคมีจะหมดไป และเมื่อใช้กระแสไฟฟ้าหมดแล้ว ไม่สามารถนำไปประจุไฟฟ้าเพื่อนำกลับมาใช้ใหม่ได้อีก เช่น ถ่านไฟฉาย เซลล์แอลคาไล เซลล์ปรอท เซลล์เงิน
2. เซลล์ทุติยภูมิ (Secondary Cell) เมื่อใช้กระแสไฟฟ้าหมดแล้ว สามารถนำไปประจุไฟฟ้าเพื่อนำกลับมาใช้ใหม่ได้อีก เช่น เซลล์สะสมไฟฟ้าแบบตะกั่ว เซลล์ไฟฟ้าแบบนิกเกิล-แคดเมียม (นิกแคด)
กระแสไฟฟ้า มี 2 ชนิด
1. ไฟฟ้ากระแสตรง (Direct Current = D.C.) มีทิศทางการไหลในวงจรทิศทางเดียวตลอดเวลา เช่น กระแสไฟฟ้าจากเซลล์ไฟฟ้าเคมีทุกชนิด กระแสไฟฟ้าจากไดนาโม
2. ไฟฟ้ากระแสสลับ (Alternating Current = A.C.) ม ีทิศทางการไหลกลับไปกลับมาในวงจร เป็นกระแสไฟฟ้าที่ได้จากไดนาโมเท่านั้น
การเกิดปฏิกิริยาเคมี สังเกตได้จากการเกิดฟองแก๊ส ตะกอน สารเปลี่ยนสี การเกิดความร้อน อุณหภูมิลดลง
ข้อมูลจาก : รัตนาภรณ์ อิทธิไพสิฐพันธุ์ และคณะ . สมุดเสริมความรู้ ทักษะปฏิบัติ และแบบทดสอบตามจุดประสงค์ วิทยาศาสตร์ ว 306 ชั้นมัธยมศึกษาปี่ที่ 3. 2543. หน้า 130-131.

