เกลือที่ละลายน้ำได้ อาจได้สารละลายที่มีสมบัติเป็นกรด เบส หรือกลางก็ได้ ซึ่งสารละลายเกลือทั้ง 3 ชนิด จะมีค่า pH ที่แตกต่างกัน ซึ่งสามารถอธิบายโดยใช้ปฏิกิริยาไฮโดรไลซิสของเกลือได้ดังตัวอย่างต่อไปนี้
เมื่อนำโซเดียมคลอไรด์ (NaCl) มาละลายน้ำ จะแตกตัวให้โซเดียมไอออน (Na+) และคลอไรด์ไอออน (Cl-) โดย Na+ เป็นไอออนที่มาจากเบสแก่ และ Cl- เป็นไอออนที่มาจากกรดแก่ ซึ่งจะไม่ทำปฏิกิริยากับน้ำทั้งคู่ ในสารละลายจึงยังคงมีปริมาณ H3O+ และ OH- ที่มาจากการแตกตัวของน้ำเท่ากัน ส่งผลให้สารละลายที่ได้มีสมบัติเป็นกลาง โดยปฏิกิริยาที่เกิดขึ้น เป็นดังนี้
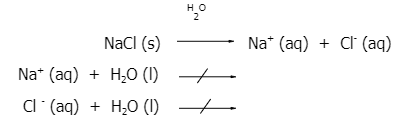
เมื่อนำแอมโมเนียมคลอไรด์ (NH4Cl) มาละลายน้ำ จะแตกตัวให้แอมโมเนียมไอออน (NH4+) และคลอไรด์ไอออน (Cl-) โดย NH4+ เป็นไอออนที่มาจากเบสอ่อน ซึ่งจะทำปฏิกิริยากับน้ำ H3O+ และ Cl- เป็นไอออนที่มาจากกรดแก่ จะไม่ทำปฏิกิริยากับน้ำ ทำให้สารละลายมี H3O+ มากกว่า OH- ส่งผลให้สารละลายมีค่า pH น้อยกว่า 7 สารละลายจึงมีสมบัติเป็นกรด โดยปฏิกิริยาที่เกิดขึ้น เป็นดังนี้
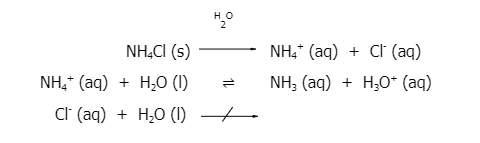
เมื่อนำโซเดียมแอซีเตต (CH3COONa) มาละลายน้ำ จะแตกตัวให้โซเดียมไอออน (Na+) และแอซีเตตไอออน (CH3COO-) โดย Na+ เป็นไอออนที่มาจากเบสแก่ จะไม่ทำปฏิกิริยากับน้ำ ส่วน CH3COO- เป็นไอออนที่มาจากกรดอ่อน ซึ่งจะทำปฏิกิริยากับน้ำได้ OH- ทำให้สารละลายมี OH-มากกว่า H3O+ ส่งผลให้สารละลายมีค่า pH มากกว่า 7 สารละลายจึงมีสมบัติเป็นเบส โดยปฏิกิริยาที่เกิดขึ้น เป็นดังนี้
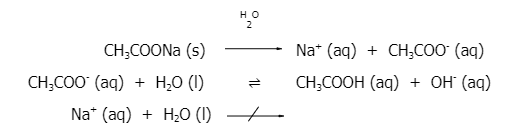
ปฏิกิริยาที่เกิดจากไอออนบวกหรือไอออนลบของเกลือทำปฏิกิริยากับน้ำ ได้ผลิตภัณฑ์เป็น H3O+ หรือ OH- ในสารละลาย เรียกว่า ปฏิกิริยาไฮโดรไลซิสของเกลือ จึงสรุปได้ว่า NH4Cl และ CH3COONa เกิดปฏิกิริยาไฮโดรไลซิส ส่วน NaCl ไม่เกิดปฏิกิริยาไฮโดรไลซิส
ดังนั้น สามารถทำนายสมบัติความเป็นกรด - เบส ของเกลือได้ โดยพิจารณาจากชนิดของกรดและเบสที่เข้ามาทำปฏิกิริยากันจนเกิดเกลือขึ้น ซึ่งจำแนกได้เป็น 3 ประเภท ดังนี้
-
เกลือที่ละลายน้ำแล้วมีสมบัติเป็นกลาง เกิดจากปฏิกิริยาระหว่างกรดแก่กับเบสแก่
-
เกลือที่ละลายน้ำแล้วมีสมบัติเป็นกรด เกิดจากปฏิกิริยาระหว่างกรดแก่กับเบสอ่อน
-
เกลือที่ละลายน้ำแล้วมีสมบัติเป็นเบส เกิดจากปฏิกิริยาระหว่างกรดอ่อนกับเบสแก่
ส่วนเกลือที่เกิดจากกรดอ่อนกับเบสอ่อน เมื่อละลายน้ำแล้วสารละลายที่ได้อาจมีสมบัติเป็นกรด เบส หรือกลางก็ได้ เนื่องจากทั้งไอออนบวกและไอออนลบสามารถเกิดปฏิกิริยาไฮโดรไลซิสได้ ดังนั้น ความเป็นกรด - เบส ของสารละลายเกลือจะพิจารณาจากการเปรียบเทียบค่า Ka และ Kb ของไอออนทั้งสอง ดังนี้
-
กรณีที่ Ka > Kb เมื่อ Ka ของไอออนบวกมีค่ามากกว่า Kb ของไอออนลบ สารละลายเกลือที่ได้จะเป็นกรด
-
กรณีที่ Ka < Kb เมื่อ Ka ของไอออนบวกมีค่าน้อยกว่า Kb ของไอออนลบ สารละลายเกลือที่ได้จะมีสมบัติเป็นเบส
-
กรณีที่ Ka ≈ Kb เมื่อ Ka ของไอออนบวกมีค่าใกล้เคียงกับ Kb ของไอออนลบ สารละลายเกลือที่ได้จะมีสมบัติเป็นกลาง
สำหรับเกลือบางชนิดที่ประกอบด้วยไอออนบวกที่มีขนาดเล็กและมีประจุสูง เช่น Al3+ Cr3+ Fe3+ Zn2+ Bi3+ Be2+ กับไอออนลบที่มาจากกรดแก่ เมื่อละลายน้ำแล้ว สารละลายที่ได้จะมีสมบัติเป็นกรด เนื่องจากไอออนบวกจะสร้างพันธะกับน้ำเกิดเป็นไฮเดรตไอออนที่สามารถเกิดปฏิกิริยาไฮโดรไลซิสได้ เช่น AlCl3 เมื่อละลายน้ำ โมเลกุลของน้ำจะล้อมรอบ Al3+ เกิดเป็น [Al(H2O)6]3+ ซึ่งสามารถเกิดปฏิกิริยาไฮโดรไลซิสได้ ดังนี้
[Al(H2O)6]3+ (aq) + H2O (l) ⇌ [Al(H2O)5(OH)]2+(aq) + H3O+ (aq)
ดังนั้น จึงสรุปได้ว่าไอออนที่เกิดปฏิกิริยาไฮโดรไลซิสได้ จะต้องเป็นไอออนที่มาจากกรดอ่อน หรือเบสอ่อน ซึ่งโดยทั่วไปปฏิกิริยาไฮโดรไลซิสจะเกิดขึ้นเพียงประมาณร้อยละ 2-5 เท่านั้น แต่ก็เพียงพอที่จะมีผลต่อ pH ของสารละลาย

