น้ำบริสุทธิ์จะแตกตัวได้น้อยมาก เนื่องจากน้ำเป็นตัวนำไฟฟ้าที่ไม่ดีและไม่สามารถตรวจด้วยเครื่องตรวจไฟฟ้าธรรมดาได้ ดังนั้นจึงจัดน้ำเป็นอิเล็กโทรไลต์อย่างอ่อน โดยการแตกตัวของน้ำบริสุทธิ์จะทำให้เกิดไฮโดรเนียมไอออนและไฮดรอกไซด์ไอออน ดังสมการ
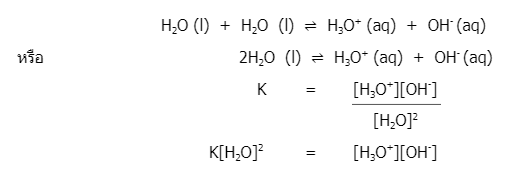
การแตกตัวของน้ำน้อยมากจนถือว่าความเข้มข้นของน้ำไม่เปลี่ยนแปลง เมื่อนำมาจัดรูปความสัมพันธ์ใหม่ จะได้ค่าคงที่การแตกตัวของน้ำ แทนด้วยสัญลักษณ์ Kw

เมื่อเพิ่มอุณหภูมิให้แก่น้ำ พบว่า น้ำมีการนำไฟฟ้าที่ดีกว่าที่อุณหภูมิต่ำ แสดงว่า น้ำที่อุณหภูมิสูงแตกตัวได้ดีกว่าน้ำที่อุณหภูมิต่ำ ค่า Kw จึงสูงกว่า
ดังนั้น ในการระบุค่า Kw ต้องระบุอุณหภูมิด้วยเช่นเดียวกับค่าคงที่อื่น และไม่ระบุหน่วย ยกเว้นในกรณีที่จะนำมาใช้คำนวณความเข้มข้นของไอออน จึงระบุหน่วยของ Kw จากสมการการแตกตัวของน้ำ จะได้ H3O+ และ OH- ที่เกิดขึ้นมีปริมาณโมลเท่ากัน ทำให้ความเข้มข้นของ H3O+ และ OH- มีค่าเท่ากันด้วย

การเปลี่ยนแปลงความเข้มข้นของไฮโดรเนียมไอออนและไฮดรอกไซด์ไอออนในน้ำ ตามหลักของเลอชาเตอลิเอ เมื่อเติมกรดลงในน้ำจะทำให้ H3O+ เพิ่มขึ้น และสมดุลของน้ำเปลี่ยนแปลงไป ดังนั้น ระบบจะปรับตัวเพื่อลดปริมาณของ H3O+ โดยจะไปรวมกับ OH- เกิดเป็นโมเลกุลของน้ำ ในการปรับตัวเมื่อเข้าสู่สมดุลใหม่ต้องใช้ OH- ในปฏิกิริยา ดังนั้น ความเข้มข้นของ OH- ในสารละลายจะลดลง ส่วนความเข้มข้นของ H3O+ จะมากขึ้น แต่ค่า Kw มีค่าคงที่ แสดงว่า ผลคูณของความเข้มข้นของไอออนทั้งสองมีค่าคงที่ ดังความสัมพันธ์ต่อไปนี้

ในทำนองเดียวกัน การเติมเบสลงในน้ำ จะทำให้ภาวะสมดุลของน้ำเปลี่ยนแปลง เมื่อระบบปรับตัวเพื่อเข้าสู่สมดุลอีกครั้ง ความเข้มข้นของ OH- จะมากกว่า 1.0 x 10-7 โมล/ลูกบาศก์เดซิเมตร ส่วนความเข้มข้นของ H3O+ จะน้อยกว่า 1.0 x 10-7 โมล/ลูกบาศก์เดซิเมตร
สรุปได้ว่า ในสารละลายที่มีน้ำเป็นตัวทำละลาย จะมีทั้ง H3O+ และ OH- รวมอยู่ด้วยกัน เมื่อความเข้มข้นของไอออนหนึ่งเพิ่มขึ้น ความเข้มข้นของอีกไอออนหนึ่งลดลง แต่ผลคูณของ [H3O+] [OH-] หรือค่า Kw ยังคงมีค่าเท่ากับ 1.0 x 10-14 เสมอ ที่อุณหภูมิ 25 องศาเซลเซียส

