95,872 Views
95,872 Views
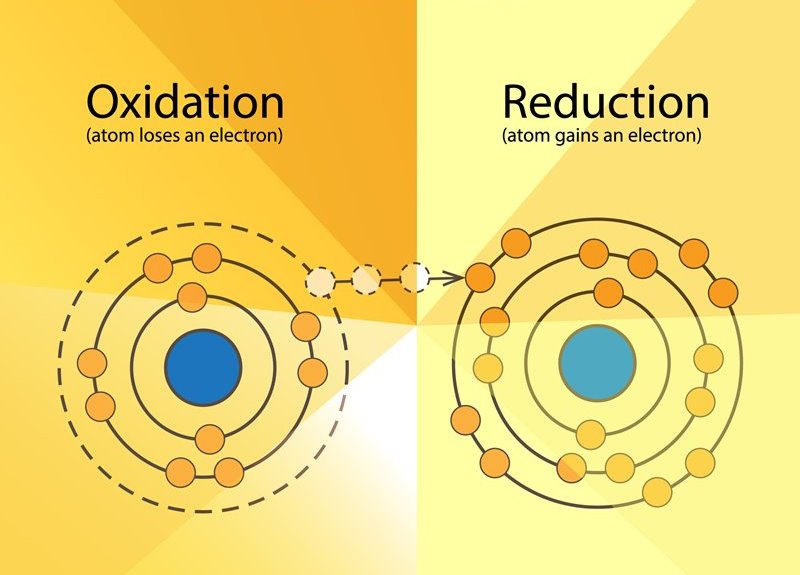
คำว่า Redox มาจากการรวมคำว่า Reduction และ Oxidation เข้าด้วยกัน ปฏิกิริยารีดอกซ์สามารถแบ่งได้เป็น 2 ขั้นตอนคือ ปฏิกิริยาออกซิเดชัน ซึ่งเป็นการให้อิเล็กตรอนแก่อะตอมอื่น และปฏิกิริยารีดักชัน เป็นปฏิกิริยาที่รับอิเล็กตรอนจากอะตอมอื่นมาใช้ (จากปฏิกิริยาออกซิเดชันในขั้นแรก) ปฏิกิริยารีดอกซ์ส่วนใหญ่แล้วจะสามารถเกิดขึ้นได้เองตามธรรมชาติ ตัวอย่างเช่น อะตอม A ทำปฏิกิริยารีดอกซ์กับอะตอม B กล่าวคืออะตอม A ส่งต่ออิเล็กตรอนให้กับอะตอม B ดังนั้นแล้ว ปฏิกิริยาที่เกิดขึ้นที่ฝั่งอะตอม A เรียกว่าออกซิเดชัน ส่วนอะตอม B ได้รับอิเล็กตรอนที่ถูกส่งมาให้ ซึ่งการรับอิเล็กตรอนเข้ามานี้เรียกว่าปฏิกิริยารีดักชัน
ถัดมาคือ คำที่มีความสำคัญต่อการเกิดปฏิกิริยารีดอกซ์ นั่นคือ เลขออกซิเดชัน (Oxidation Number หรือ ON) ซึ่งเป็นค่าประจุไฟฟ้าที่ถูกสมมติขึ้นแต่สะท้อนคุณสมบัติอย่างง่ายของธาตุหรืออะตอมของธาตุนั้น ๆ โดยทั่วไปเลขออกซิเดชันของธาตุอิสระ เช่น Na O2 Cl จะมีค่าเป็นศูนย์ (0) เลขออกซิเดชันของธาตุในหมู่โลหะ (IA, IIA) เมื่ออยู่ในสารประกอบจะมีค่าเป็น +1 และ +2 ตามลำดับ เลขออกซิเดชันของไฮโดรเจนเป็น -1 เมื่ออยู่ในสารประกอบของโลหะ และเป็น +1 เมื่ออยู่ในสารประกอบอโลหะ เป็นต้น
ตัวอย่างเช่น ธาตุไฮโดรเจน (H) เมื่อจับคู่กับธาตุอโลหะอย่างออกซิเจน (O) ได้เป็น H2O ซึ่งไฮโดรเจนจะมีเลขออกซิเดชันเป็น +1 แต่ถ้ารวมกับโลหะอย่างโซเดียม (Na) ได้เป็น NaH ซึ่งไฮโดรเจนจะมีเลขออกซิเดชันเป็น -1 ทั้งนี้มีหลักการการคำนวณเลขออกซิเดชันพื้นฐานสำหรับการจับคู่ของอะตอมของธาตุยอดนิยมเพื่อให้กลายเป็นสารต่าง ๆ ที่สำคัญคือ ผลรวมของเลขออกซิเดชันของอะตอมทั้งหมดในสารประกอบจะมีค่าเท่ากับ 0 ยกเว้นกรณีที่สารนั้น ๆ มีประจุไอออนแบบต่าง ๆ และนั่นทำให้สารตัวนั้นไม่มีประจุหรือเป็นกลาง แต่สำหรับโมเลกุลของสารใด ๆ ที่มีประจุไอออน เช่น SO42- แปลว่ามีไอออนอยู่ 2 ซึ่งทำให้การรวมเลขออกซิเดชันของอะตอมทั้งหมดต้องมีค่าเท่ากับประจุ หรือไอออนของสารนั้นๆ
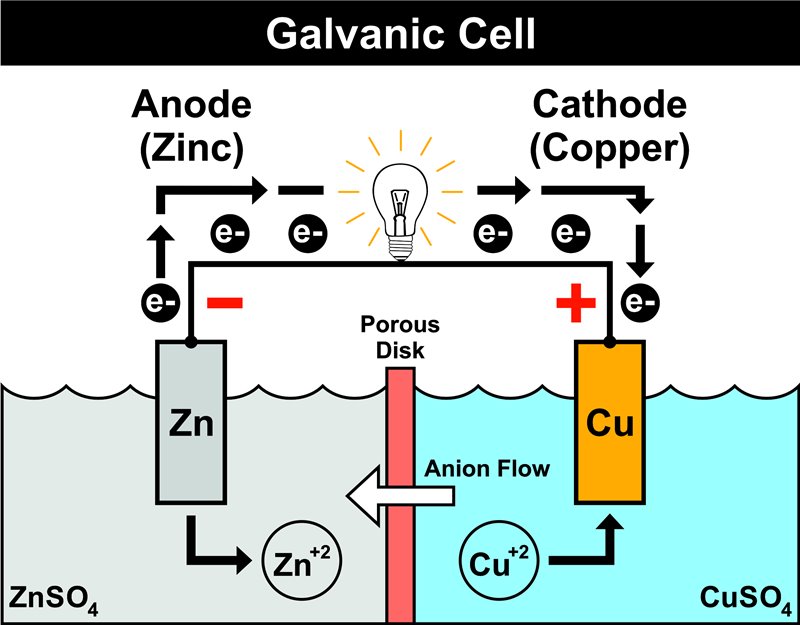
การทำความเข้าใจการจับตัว การจับคู่และส่งต่ออิเล็กตรอนของอนุภาคอื่น ๆ จะพบว่า สามารถนำมาใช้งานในชีวิตประจำวันได้มากมาย ที่เห็นชัด ๆ คือการชุบโลหะ ตัวอย่างเช่น การนำแผ่นโลหะสังกะสี (Zn) จุ่มลงไปในสารละลายของทองแดง (Cu2+) แผ่นสังกะสีจะเริ่มกร่อนเนื่องจากมันสูญเสียอนุภาคอิเล็กตรอนให้อีกด้านหนึ่งของปฏิกิริยาไป สารละลายทองแดงจะเริ่มเปลี่ยนสีจากสีฟ้าเป็นใส ไม่มีสี และทองแดงบางส่วนจะเริ่มเข้าไปจับตัวกับแผ่นสังกะสี ซึ่งนี่เป็นหลักการการชุบโลหะ นอกจากนั้นยังมีการใช้ประโยชน์จากปฏิกิริยารีดอกซ์เพื่อผลิตแบตเตอรี แยกสารด้วยไฟฟ้า ตลอดจนการทำสารให้บริสุทธิ์ เป็นต้น