แรงแวนเดอร์วาลส์ VAN DER WAALS FORCES
ทีมงานทรูปลูกปัญญา | 2015-12-15 14:08:34
แรงแวนเดอร์วาลส์ คือ แรงดึงดูดแบบอ่อนๆที่ช่วยยึดโมเลกุลเข้าด้วยกัน เช่น แก๊สไฮโดรเจน คาร์บอนไดออกไซด์ ไนโตรเจน และในแก๊สเฉื่อย เช่น ฮีเลียม (He), นีออน (Ne), อาร์กอน (Ar) และ คริบตอน (Kr) เป็นต้น
แรงแวนเดอร์วาลส์ มี 3 ชนิด คือ
1. แรง dipole-dipole
2. แรง dipole-induced dipole
3. แรง London (dispersion)
1. แรง dipole-dipole เป็นแรงที่เกิดจากการกระทำระหว่างโมเลกุลแบบมีขั้วซึ่งมี ไดโพลแบบถาวร โดยทั่วไปแล้วแรงไดโพลขึ้นอยู่กับ การจัดเรียงตัวสัมพัทธ์ของโมเลกุลและตำแหน่งที่อยู่ ดังรูป
ลักษณะการจัดตัวของไดโพลคู่ซึ่งให้ผลออกมา เป็นแรงดึงดูด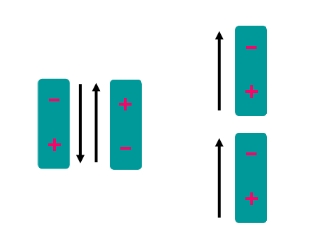
ลักษณะการจัดตัวของไดโพลคู่ซึ่งให้ผลออกมา เป็นแรงผลัก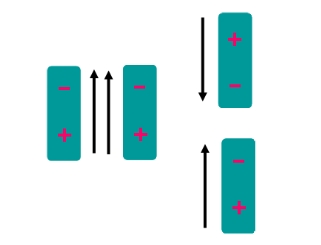
แรงไดโพลมีบทบาทสำคัญในการจัดเรียงตัวที่เป็นระเบียบของโมเลกุลในผลึก สำหรับโมเลกุลในสถานะแก๊สและของเหลว โมเลกุลมีการจัดเรียงตัวอย่างไม่เป็นระเบียบ เพราะมีการเคลื่อนไหวมากจึงเป็นผลให้แรงไดโพลมีทั้งแบบผลักและดึงดูด ซึ่งทำให้แรงลัพธ์ออกมา เป็นแรงดึงดูดอย่างอ่อนๆ
2. แรง dipole-induced dipole คือ แรงที่เกิดจากโมเลกุลที่มีขั้วเหนี่ยวนำให้โมเลกุล หรืออะตอมตัวอื่นมีขั้วด้วย จากนั้นอะตอมหรือโมเลกุลดังกล่าวก็มีแรงกระทำต่อกันเกิดขึ้น ซึ่งแรงนี้จะมากหรือน้อยขึ้นอยู่กับความสามารถในการเกิดมีขั้ว (polarizability) ของโมเลกุลที่ถูกเหนี่ยวนำ โดยทั่วไปอะตอมหรือโมเลกุลที่มีขนาดใหญ่ จะมีความสามารถในการเกิดมีขั้วสูงกว่า อะตอมหรือโมเลกุลที่มีขนาดเล็ก
การเกิด แรง dipole-induced dipole เช่น HCl กับ Ar แสดงได้ดังรูป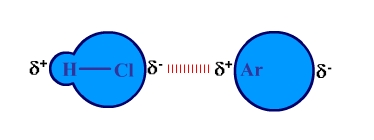
3. แรง London (dispersion) คือ แรงดึงดูดระหว่างโมเลกุลที่ไม่มีขั้วด้วยกัน เช่น O2, Ne2 เป็นต้น เนื่องจากอิเล็กตรอนเคลื่อนที่แบบไร้ทิศทางทำให้บางครั้ง อิเล็กตรอนมากระจุกกันอยู่บริเวณเดียวกันทำให้เกิดประจุลบบางส่วน(ประจุลบชั่วคราวที่มีค่าประจุน้อยมาก)เกิดขึ้น และทำให้บริเวณที่ไม่มีอิเล็กตรอนอยู่เกิดประจุบวกบางส่วน(ประจุบวกชั่วคราวที่มีค่าประจุน้อยมาก) ซึ่งแสดงได้ดังรูป
หลังจากอะตอมจะกลายเป็นอะตอมที่มีขั้วชั่วคราว อะตอมที่มีขั้วก็จะเหนี่ยวนำให้อะตอมใกล้เคียงกลายเป็นอะตอมที่มีขั้วตามไปด้วย ซึ่งแสดงได้ดังรูป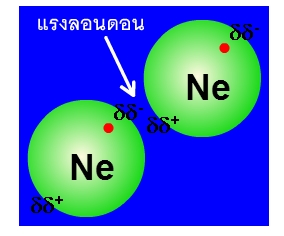
จากรูปแสดงการเกิดแรงลอนดอนของ Ne โดยจุดสีแดงคือ electron จะเห็นว่าบางครั้งอิเล็กตรอนอยู่ ณ.บริเวณใดบริเวณหนึ่งของอะตอมมากกว่าบริเวณหนึ่ง กลายเป็นอะตอมที่มีขั้วบางส่วน จากนั้นก็จะเหนี่ยวนำให้อะตอม Ne ใกล้เคียงกลายเป็นอะตอมที่มีขั้วบางส่วนตามไปด้วย จึงเกิดแรงดึงดูดซึ่งกันและกันแต่ว่าเป็นแรงดึงดูดแบบอ่อน
โดยทั่วไปแล้วที่ความดันสูงและอุณหภูมิต่ำแรงแวนเดอร์วาลส์สามารถทำให้โมเลกุลของแก๊สที่ไม่มีขั้วกลายเป็นโมเลกุล
ในสถานะของเหลวได้
แรงชนิดนี้จะมีความแข็งแรงมากขึ้นถ้าโมเลกุลมีขนาดใหญ่ขึ้น ทำไม? นั่นเป็นเพราะว่าโมเลกุลขนาดใหญ่กว่าจะมีอิเล็กตรอนมากกว่า ซึ่งบางครั้งอิเล็กตรอนเหล่านั้นมารวมกันอยู่ ณ บริเวณหนึ่งๆในอะตอมมากกว่าบริเวณหนึ่งทำให้เกิดประจุบางส่วนขึ้น แต่เนื่องจากมีจำนวนอิเล็กตรอนมากดังนั้นประจุที่เกิดจึงมีค่ามากกว่าจึงเหนี่ยวนำให้เกิดประจุที่แข็งแรงกว่า
ข้อควรรู้ ก่อนที่อะตอมจะรวมกันเป็นพันธะไอออนิก หรือพันธะโคเวเลนต์ สามารถเกิดแรงแวนเดอร์วาลส์ขึ้นมาก่อนที่จะเกิดพันธะดังกล่าวได้แต่แรงแวนเดอร์วาลส์มีค่าน้อยมาก เมื่อเทียบกับแรงที่เกิดขึ้นอันเนื่องมาจากพันธะเคมี
ที่มา https://www.il.mahidol.ac.th/e-media/ap-chemistry1/chemical_bonding/vanderwaals.htm