ผังมโนทัศน์สาระการเรียนรู้
สาระสำคัญ
1. ปฏิกิริยาเคมี เกิดขึ้นเมื่อสารเริ่มต้นเข้าทำปฏิกิริยากัน เกิดการแตกสลายของพันธะเดิมและสร้างพันธะใหม่เป็นผลิตภัณฑ์ที่มีสมบัติแตกต่างจากสารเริ่มต้น
2. สมการเคมีเขียนแทนด้วยสูตรเคมีหรือสัญลักษณ์ของธาตุ ใช้เพื่อแสดงความสัมพันธ์ระหว่างสารเริ่มต้น กับผลิตภัณฑ์ ตลอดจนสารอื่น ๆ ที่มีส่วนเกี่ยวข้องกับการเกิดปฏิกิริยาเคมี
3. การเขียนสมการเคมีจะใช้สัญลักษณ์ตัวอักษรภาษาอังกฤษเล็กแทนสถานะของสารเริ่มต้นและผลิตภัณฑ์ โดยจะต้องมีการดุลสมการเคมี เพื่อทำจำนวนอะตอมของธาตุในสารเริ่มต้นให้เท่ากับจำนวนอะตอมของธาตุในผลิตภัณฑ์
4. การวัดอัตราเร็วของปฏิกิริยาเคมีจะวัดจากปริมาณของสารเริ่มต้นที่ลดลงใน 1 หน่วยเวลา หรือ ปริมาณของผลิตภัณฑ์ที่เพิ่มขึ้นใน 1 หน่วยเวลา เรียกว่า อัตราการเกิดปฏิกิริยาเคมี ซึ่งมีความสัมพันธ์ดังนี้
อัตราการเกิดปฏิกิริยาเคมี = ปริมาณของสารเริ่มต้นที่ลดลง / เวลาที่ใช้ในการเกิดปฏิกิริยา
หรือ อัตราการเกิดปฏิกิริยาเคมี = ปริมาณของผลิตภัณฑ์ที่เพิ่มขึ้น / เวลาที่ใช้ในการเกิดปฏิกิริยา
5. ปัจจัยที่มีผลต่ออัตราการเกิดปฏิกิริยา คือ ความเข้มข้นของสารเริ่มต้น พื้นที่ผิวของสารที่เข้าทำปฏิกิริยา อุณหภูมิ ตัวเร่งปฏิกิริยา และธรรมชาติของสาร
6. มนุษย์สามารถนำปฏิกิริยาเคมีไปใช้ประโยชน์ในบ้าน ทางการเกษตร และทางอุตสาหกรรมได้
ปฏิกิริยาเคมีบางชนิดก็อาจเป็นอันตรายต่อสิ่งมีชีวิตและสิ่งแวดล้อม เช่น การเกิดฝนกรด
Keywords
ปฏิกิริยาเคมี : การเปลี่ยนแปลงทางเคมีของสารเริ่มต้นไปเป็นสารผลิตภัณฑ์
สมการเคมี : สมการที่ใช้เพื่อแสดงความสัมพันธ์ระหว่างสารเริ่มต้นกับผลิตภัณฑ์ที่แทนสูตรเคมีหรือสัญลักษณ์ของธาตุ
อัตราการเกิดปฏิกิริยาเคมี : ปริมาณสารเริ่มต้นที่ลดลงหรือสารผลิตภัณฑ์ที่เพิ่มขึ้นใน 1 หน่วยเวลา
ตัวเร่งปฏิกิริยา : สารที่เพิ่มเข้าไปแล้วทำให้ปฏิกิริยานั้นเกิดเร็วขึ้น โดยเมื่อสิ้นสุดปฏิกิริยายังคงมีปริมาณและสมบัติทางเคมีเหมือนเดิม
ตัวหน่วงปฏิกิริยา : สารที่เพิ่มเข้าไปแล้วทำให้ปฏิกิริยาเกิดช้าลง
ปฏิกิริยาเคมี
สมการและการเกิดปฏิกิริยาเคมี
ปฏิกิริยาเคมี (chemical reaction) คือ การเปลี่ยนแปลงทางเคมีของสารเริ่มต้นแล้วทำให้เกิดผลิตภัณฑ์ ขณะที่เกิดปฏิกิริยาเคมี สารเริ่มต้นหรือตัวทำปฏิกิริยา (reactant) จะเข้าทำปฏิกิริยากัน ทำให้โมเลกุลของสารเริ่มต้นเกิดการแตกสลายของพันธะเดิมแล้วสร้างพันธะใหม่ เกิดเป็นผลิตภัณฑ์ (product) ที่มีสมบัติแตกต่างจากสารเริ่มต้น
ความหมายและการเขียนสมการเคมี
สมการเคมี (chemical equation) คือ การเขียนแสดงความสัมพันธ์ระหว่างสารเริ่มต้นกับผลิตภัณฑ์ ด้วยสูตรเคมีหรือสัญลักษณ์ของธาตุ โดยใช้ตัวอักษรภาษาอังกฤษในวงเล็บเพื่อแสดงถึงสถานะของสารเริ่มต้นและผลิตภัณฑ์
|
สัญลักษณ์ที่ใช้ในสมการเคมี s (solid) ใช้แทนของแข็ง l (liquid) ใช้แทนของเหลว g (gas) ใช้แทนแก๊ส aq (aqueous) ใช้แทนสารละลายที่มีน้ำ เป็นตัวทำละลาย |
ใช้ → แสดงถึงทิศทางของการเกิดปฏิกิริยาจากซ้ายมือไปขวามือ ซึ่งเป็นการเปลี่ยนแปลงไปข้างหน้าทิศทางเดียว และ ← แสดงการเกิดปฏิกิริยาที่ผันกลับได้ ซึ่งมีทั้งปฏิกิริยาที่ไปข้างหน้า คือ สารเริ่มต้นเปลี่ยนเป็นผลิตภัณฑ์ และปฏิกิริยาย้อนกลับ คือ ผลิตภัณฑ์เปลี่ยนกลับมาเป็นสารเริ่มต้น |
การเกิดปฏิกิริยาเคมี
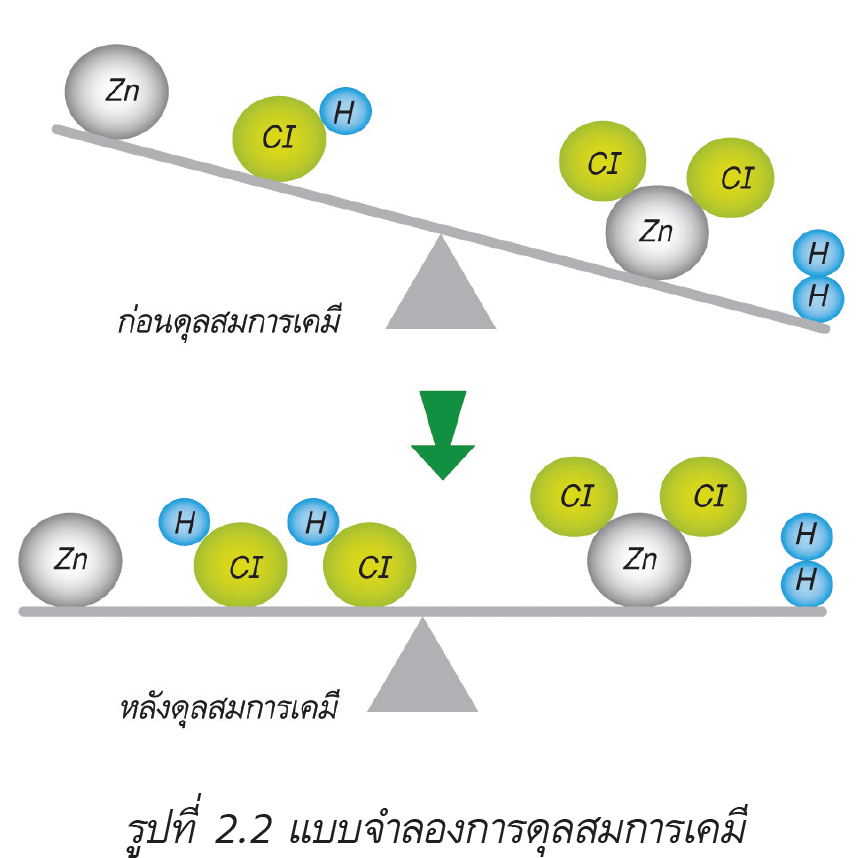
เมื่อแผ่นสังกะสี (Zn) ทำปฏิกิริยากับสารละลายกรดไฮโดรคลอริก (HCl) ได้ผลิตภัณฑ์เป็นสารประกอบเกลือของซิงค์ (II) คลอไรด์ (ZnCl2) กับแก๊สไฮโดรเจน (H2)

ในการเขียนสมการเคมีจะต้องทำจำนวนอะตอมของธาตุในสารเริ่มต้นให้เท่ากับจำนวนอะตอมของธาตุในผลิตภัณฑ์ นั่นคือ การดุลสมการเคมี ซึ่งเป็นการนำตัวเลขที่เหมาะสมเติมลงข้างหน้าสูตรในสมการ ดังนั้น สมการเคมีระหว่างโลหะสังกะสีกับสารละลายกรดไฮโดรคลอริกที่ดุลแล้ว คือ
Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g)
สรุปหลักในการเขียนสมการเคมี
1. ต้องทราบสูตรของสารเริ่มต้น ผลิตภัณฑ์ และสถานะของสารทั้ง 2 ชนิด
2. ในกรณีที่สารเริ่มต้นเปลี่ยนไปเป็นผลิตภัณฑ์ทิศทางเดียวให้เขียนสารเริ่มต้นไว้ทางด้านซ้าย ส่วนผลิตภัณฑ์อยู่ทางด้านขวา โดยใช้ → คั่นกลาง และในกรณีที่สารเริ่มต้นเปลี่ยนไปเป็นผลิตภัณฑ์และผลิตภัณฑ์เปลี่ยนกลับมาเป็นสารเริ่มต้นได้ให้ใช้
3. สมการเคมีที่จำนวนอะตอมของธาตุในสารเริ่มต้นไม่เท่ากับจำนวนอะตอมของธาตุในผลิตภัณฑ์ให้ดุลสมการเคมี โดยดุลจำนวนอะตอมของสารในโมเลกุลที่มีจำนวนอะตอมมากก่อนโมเลกุลที่มีจำนวนอะตอมน้อย
4. โมเลกุลของน้ำ (H2O) และธาตุอิสระ เช่น O2, Na, Cl และ H2 ให้ดุลจำนวนอะตอมทีหลัง
อัตราการเกิดปฏิกิริยาเคมี
อัตราการเกิดปฏิกิริยาเคมี (rate of reaction) คือ อัตราเร็วของปฏิกิริยาเคมีซึ่งวัดจากปริมาณของสารเริ่มต้นที่ลดลงใน 1 หน่วยเวลา หรือปริมาณของผลิตภัณฑ์ที่เพิ่มขึ้นใน 1 หน่วยเวลา ซึ่งมีความสัมพันธ์ดังนี้
อัตราเร็วของรถยนต์ = ระยะทางที่รถยนต์วิ่งได้ / เวลาที่ระยนต์วิ่ง
อัตราการเกิดปฏิกิริยาเคมี = ปริมาณของสารเริ่มต้นที่ลดลง / เวลาที่ใช้ในการเกิดปฏิกิริยา
หรือ อัตราการเกิดปฏิกิริยาเคมี = ปริมาณของผลิตภัณพ์ที่เพิ่มขึ้น / เวลาที่ใช้ในการเกิดปฏิกิริยา
การวัดปริมาณสารเริ่มต้นที่ลดลงหรือผลิตภัณฑ์ที่เกิดขึ้นจะใช้สมบัติและลักษณะของสารเป็นเกณฑ์ ได้แก่ วัดปริมาณเมื่อสารเป็นแก๊ส วัดความเข้มข้นเมื่อเป็นสารละลาย และชั่งมวลเมื่อสารเป็นของแข็ง
ปัจจัยที่มีผลต่ออัตราการเกิดปฏิกิริยาเคมี
ปัจจัยที่มีผลต่ออัตราการเกิดปฏิกิริยาเคมี ได้แก่
ความเข้มข้นของสารเริ่มต้น
อัตราการเกิดปฏิกิริยาเคมีของสารส่วนใหญ่ในช่วงเริ่มต้นจะเป็นไปอย่างรวดเร็วเนื่องจากสารเริ่มต้นจำนวนหนึ่งจะถูกใช้ไปในปฏิกิริยา และจะช้าลงเมื่อผ่านไประยะหนึ่ง สำหรับปฏิกิริยาเคมีที่มีสารเริ่มต้นมากกว่า 1 ชนิด หากต้องการทราบว่าอัตราการเกิดปฏิกิริยาเคมีอาจขึ้นอยู่กับความเข้มข้นของสารเริ่มต้นชนิดใด สามารถทำได้โดยเปลี่ยนความเข้มข้นของสารเริ่มต้นทีละชนิด พร้อมทั้งควบคุมความเข้มข้นของสารเริ่มต้นอื่น ๆ ให้คงที่
พื้นที่ผิวของสารที่เข้าทำปฏิกิริยา
สารเริ่มต้นที่เป็นของแข็งมีที่พื้นผิวต่างกัน อัตราการเกิดปฏิกิริยาก็จะต่างกัน เช่น เมื่อใช้แคลเซียมคาร์บอเนตที่เป็นผง และเป็นก้อนปริมาณเท่ากัน นำมาทำปฏิกิริยากับสารละลายกรดไฮโดรริกที่มีความเข้มข้นและปริมาตรเท่ากัน พบว่าแคลเซียมคาร์บอเนตชนิดผงมีอัตราการเกิดปฏิกิริยาเคมีเร็วกว่าแคลเซียมคาร์บอเนตชนิดก้อน สรุปได้ว่าสารเริ่มต้นที่มีพื้นที่ผิวมากจะส่งผลให้การอัตราเกิดปฏิกิริยาเกิดได้รวดเร็วมากขึ้น
อุณหภูมิ
สารบางชนิดเกิดปฏิกิริยาได้ดีที่อุณหภูมิสูง ในขณะที่บางชนิดต้องใช้อุณหภูมิต่ำ
ตัวเร่งปฏิกิริยา
การใส่ตัวเร่งปฏิกิริยา (catalyst) จะทำให้ปฏิกิริยานั้นเกิดเร็วขึ้น โดยที่สารดังกล่าวยังคงมีปริมาณและสมบัติทางเคมีเหมือนเดิมแม้ว่าปฏิกิริยาจะสิ้นสุดลงแล้วก็ตาม แต่ในบางกิริยาเมื่อเติมสารบางชนิดลงไปแล้วจะทำให้ปฏิกิริยาเกิดช้าลง สารที่เพิ่มเข้าไปนี้เรียกว่า ตัวหน่วงปฏิกิริยา (inhibitor) ซึ่งมีประโยชน์ในปฏิกิริยาที่ต้องการให้เกิดผลิตภัณฑ์หรือเกิดปฏิกิริยาช้าลง
ธรรมชาติของสาร
เนื่องจากแต่ละชนิดจะมีสมบัติเฉพาะตัวแตกต่างกันจึงใช้เวลาในการเข้าทำปฏิกิริยาต่างกัน
ปฏิกิริยาเคมีที่มีผลต่อสิ่งมีชีวิตและสิ่งแวดล้อม
การศึกษาอัตราการเกิดปฏิกิริยาเคมี ตลอดจนปัจจัยที่มีผลต่อการเกิดปฏิกิริยาจะทำให้สามารถควบคุมปฏิกิริยาต่าง ๆ และสามารถนำปฏิกิริยาเหล่านั้นมาใช้ประโยชน์ในด้านต่างๆ ได้ เช่น ปฏิกิริยาการสลายตัวของเบกกิงโซดาหรือโซเดียมไฮโดรเจนคาร์บอเนต (NaHCO3) ด้วยความร้อนแล้วให้โซเดียมคาร์บอเนต (Na2CO3) แก๊สคาร์บอนไดออกไซด์ (CO2) และน้ำ (H2O) ที่สามารถนำไปใช้ทำขนมต่าง ๆ ปฏิกิริเคมีดังกล่าวมีสมการดังนี้
ความร้อน
2NaHCO3(s) ————→ Na2CO3(s) + CO2(g) + H2O(l)
ขณะเดียวกันปฏิกิริยาเคมีบางชนิดก็กาจก่อให้เกิดอันตรายได้ เช่น การใช้ผลิตภัณฑ์ทำความสะอาดห้องน้ำซึ่งมีส่วนผสมของกรดไฮโดรคลอดริก (HCl) จะเกิดปฏิกิริยากับแคลเซียมคาร์บอเนต (CaCO3) ซึ่งเป็นส่วนประกอบที่ใช้ยาแนวระหว่างแผ่นกระเบื้อง ได้แคลเซียมคลอไรด์ (CaCl2) และได้แก๊สคาร์บอนไดออกไซด์ ดังปฏิกิริยา
CaCO3(s) + 2HCl(aq) ————→ CaCl2(aq) + H2O(l) + CO2(g)
ซึ่งจะทำให้เกิดการระคายเคืองต่อตาและระบบทางเดินหายใจ นอกจากนี้ยังมีปฏิกิริยาอื่น ๆ ที่อาจส่งผลกระทบต่อสิ่งมีชีวิตและสิ่งแวดล้อม เช่น ฝนกรด (H2SO4) ที่เกิดจากกำมะถันทำปฏิกิริยารวมตัวกับแก๊สออกซิเจนในอากาศได้ผลิตภัณฑ์เป็นแก๊สซัลเฟอร์ไดออกไซด์ (SO2) เมื่อฝนตกลงมาจะทำให้สิ่งก่อสร้างผุกร่อนหรือเป็นสนิม นอกจากนี้ฝนกรดยังสามารถทำปฏิกิริยากับหินปูน (CaCO3) หรือหินอ่อนซึ่งเป็นส่วนประกอบของอาคารบ้านเรือนได้อีกด้วย โดยมีสมการดังนี้
CaCO3 + H2SO4(aq) ————→ CaSO4(s) + CO2(g) + H2O(l)

แหล่งที่มาของเนื้อหา : สำนักพิมพ์วัฒนาพานิช www.wpp.co.th

